标签:编码 his 需要 logs none pop 聚合 gen 融合
“Epidermal growth factor receptor”,表皮生长因子受体。别名:ErbB1,或 HER1
EGFR是ErbB基因家族的成员之一。ErbB基因家族包括了:EGFR(ErbB1)、HER2(ErbB2)、ErbB3、ErbB4。其中,HER2又称为ErbB2。
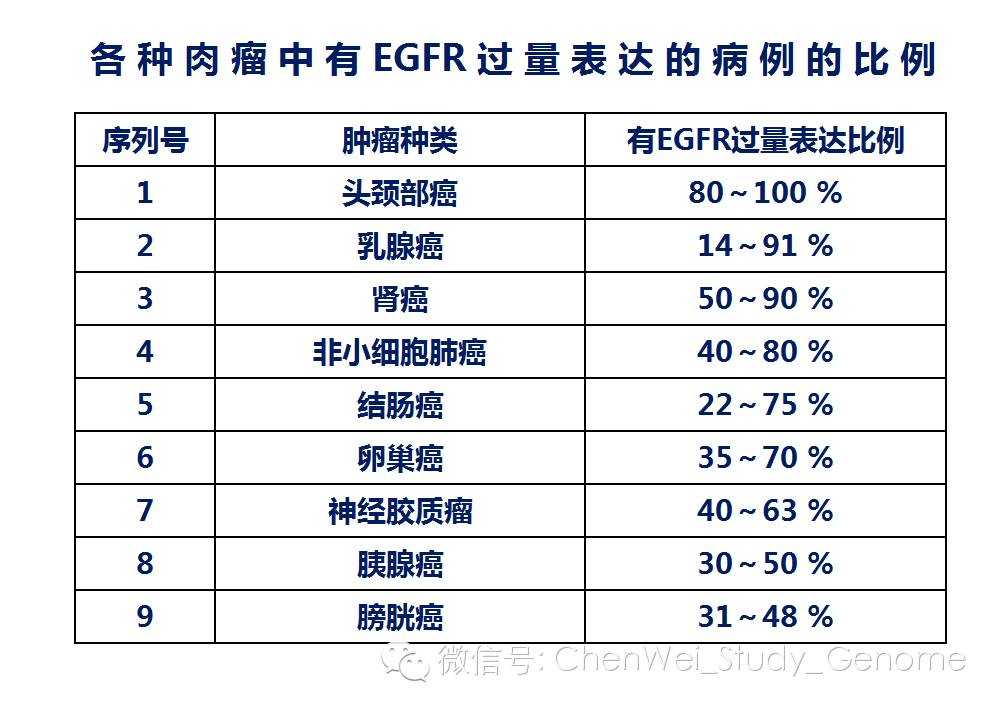
EGFR是目前肿瘤靶向治疗当中,最重要的靶子。其突变,会在很大程度上影响到多种靶向治疗有效性。
位于chr7 短臂 ,蛋白分子量170KDa,跨膜蛋白 定位于细胞膜上,细胞膜外的部分,负责与各种配体相结合。
它细胞膜内的部分,在激活的条件下,会拥有酪氨酸激酶的活性。当EGFR单体与配体结合之后,两个带有配体的EGFR单体,就会相互结合,形成有激酶活性的二聚体。
在EGFR形成二聚体后,二聚体的磷酸激酶活性就会发挥作用。
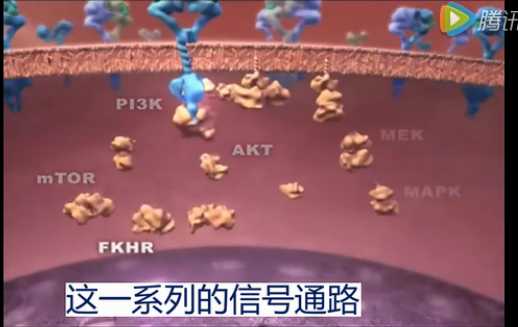
单体 ---> 二聚体 ---> 自磷酸化 ---> 成络氨酸激酶活性加强 ---> 激活RAS、MAPK、Src、STAT 3/5、PLCg、PKC 和 PI3-kinase,这一系列的信号通路。
通过激活下游的信号通路,EGFR可以促进细胞的增殖、分化、和迁移。
EGFR在肿瘤中的变异,分为数量变异、和结构变异两种:
数量变异:表达量异常高表达。。有些是因为EGFR的基因发生了异常的拷贝数增加;还有一些,是因为调控EGFR的某些调控因子发生了的变异,。
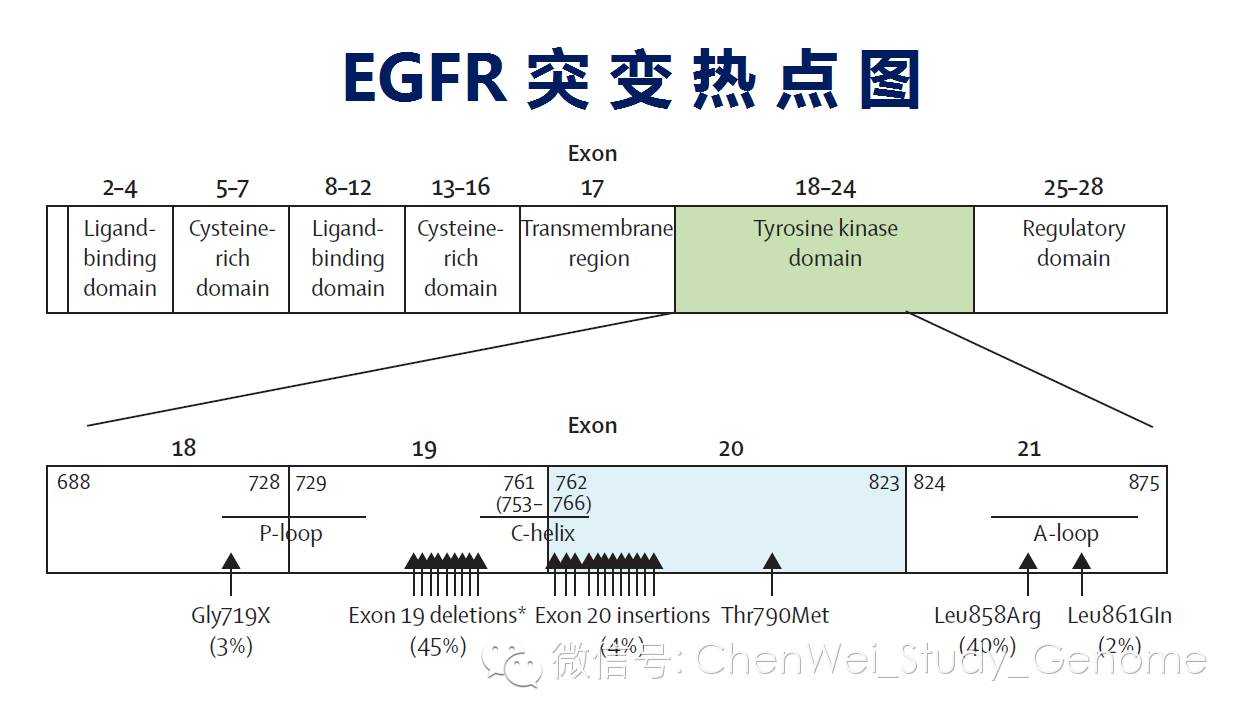
EGFR的结构变异。
EGFR的激活突变、和耐药突变,集中在第18号外显子到第24号外显子之间。
例如:第19号外显子的缺失变异、和L858R变异,也就是第858号氨基酸残基,从亮氨基变成了精氨基,都会导致EGFR不需要与配体结合,就直接拥有了持续的酪氨酸激酶活性。
针对EGFR的靶向治疗药物,和新药研发策略。
目前,已经上市的针对EGFR的肿瘤靶向治疗药物,有抗体药、和酪氨酸激酶抑制剂药,这2大类药物。
抗体药的原理,就是用一个特异地识别EGFR与配体结合的那个部位的抗体,来与配体竞争EGFR通过阻断配体结合到EGFR上,来阻断了配体对EGFR的激活作用。
酪氨酸激酶抑制剂,简称“TKI”。TKI的共同特点,与ATP竞争EGFR的酪氨酸激酶活性中心,进而抑制EGFR对下游生物信号通路的激活作用。如:吉非替尼、厄洛替尼、拉帕替尼、埃克替尼
HER2基因,是乳腺癌和胃癌靶向治疗中重要的生物标志物。
在20~30%的乳腺癌病例中,有HER2的过量表达;在10~30%的胃癌(病例)当中,有HER2的过量表达。有过量表达的预后差、生存期短
位于第chr17 长臂。它编码长度为1255 aa的蛋白质,翻译出来的蛋白质经过糖基化,分子量达到185KD,被转运到细胞膜上,成为一个跨膜蛋白。
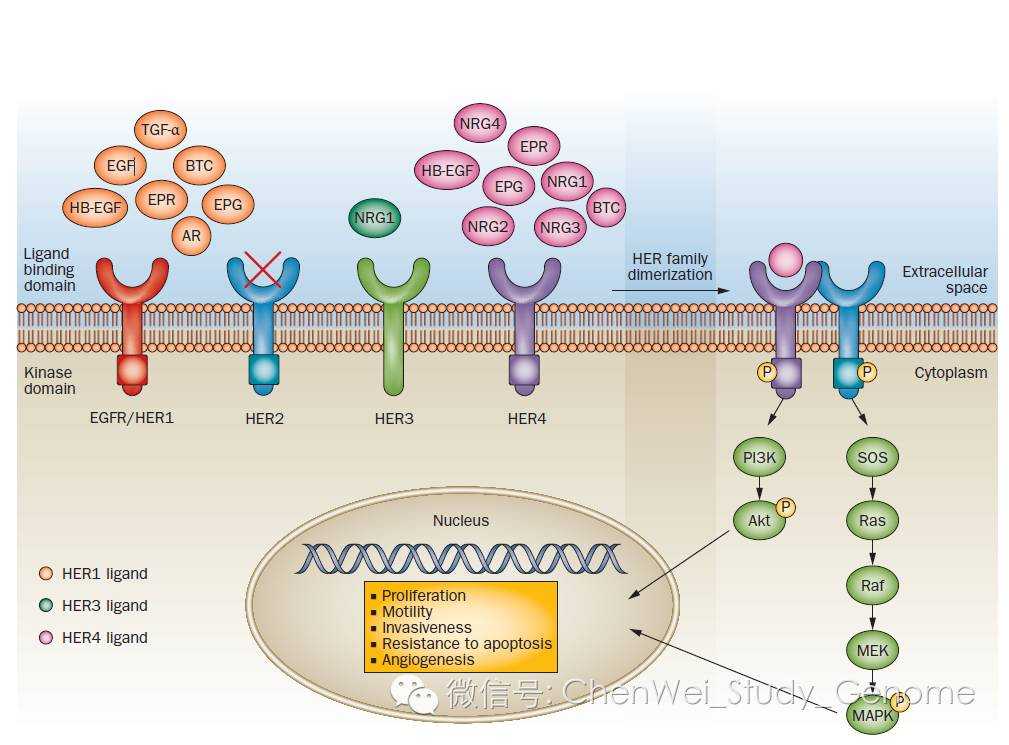
HER2蛋白是一个酪氨酸激酶。
HER2通过二聚体化,也就是两个EGFR家族的单体蛋白结合在一起,成为一个二聚体蛋白。这其中,可以两个HER2单体结合在一起,成为一个HER2的同源二聚体;也可以是HER2与EGFR1、或者EGFR3、EGFR4组成异源二聚体。
已知的EGFR家族的配体有:
1、EGF (Epidermal growth factor)
2、TGF-α (transforming growth factor-α)
3、HB-EGF (heparin-binding EGF-likegrowth factor)
4、AR (amphiregulin)
5、BTC (betacellulin)
6、EPR (epiregulin)
7、EPG (epigen)
8、NRG1 (neuregulin-1)
9、NRG2 (neuregulin-2)
10、NRG3 (neuregulin-3)
11、NRG4 (neuregulin-4) 一共11种已知配体。
二聚体与这些配体结合之后,就被激活(磷酸化),然后激活下游信号通路当中的蛋白。在各种二聚体当中,HER2-EGFR3形成的二聚体具有最强的激活下游信号通路的能力。
下游信号通路当中,最主要的是2个:
第1个是RAS-MAPK通路
第2个是PI3K-AKT信号通路
其它还有PLC-PKC信号通路等
这些信号通路被激活之后,被激活的蛋白因子进入到细胞核当中,启动下游的各种功能。这些功能包括:
1、细胞增殖
2、细胞迁移
3、细胞在组织中的侵袭
4、细胞抵抗凋亡
5、促进细胞周围形成血管
总之,都是促进细胞生长、和迁移的能力。
HER2基因的变异,最常见的是HER2基因的拷贝数增加。腺癌当中,20~30%的病例有HER2基因拷贝数的增加。
细胞膜表面的HER2蛋白有很多的时候,HER2和各种二聚体,就可以不依赖外界配体,直接激活下游的信号通路。
在临床上,HER2阳性比例高的肿瘤如下:
乳腺癌,20~30%
胃癌,10~30%
食道癌,17%左右
卵巢癌,20~30%
子宫内膜癌,21~47%
肺癌,20%
膀胱癌,12%
针对HER2的临床检测
针对HER2的临床检测,分成对HER2蛋白表达量的免疫组织化学检测(IHC,Immuno histochemistry),和针对HER2基因拷贝数量的原位杂交检测(ISH,in situ hybridization)。
EGFR和ALK等基因,都是激酶。而且它们的突变引起癌症,都是因为细胞对它们的激酶活性失去了控制,而且失控的激酶活性变得很强,这就导致了癌症。
位于chr 17 短臂上。P53基因编码的蛋白质,有393个氨基酸残基。
蛋白刚翻译出来的时候,以单体形式存在。单体形式是没有活性的,只有当4个单体聚合成一个四聚体之后,这个四聚体才是有活性的。
据统计数据显示,50%以上的肿瘤病例当中,有P53基因的突变、或者有P53基因的丢失。
P53蛋白在抑制细胞的癌变中,主要起四个作用:
第1,当有DNA损伤的时候,P53就可以把让细胞停留在细胞周期的G1期,不让细胞进入到S期。也就是不让有DNA损伤的细胞进行分裂、增殖。
第2,在DNA受到损伤的时候,P53会启动对DNA的修复功能。
第3,对于难以修复DNA损伤的细胞,就将细胞老化,Senescence。也就是让这个细胞永远不能分裂。
第4,当DNA有严重的损伤的时候,P53会启动细胞的凋亡,apoptosis。所谓细胞的凋亡,也就是细胞的程序性自杀机制。
对P53的调控
P53所受到的上游调控,分成对P53蛋白浓度的调控、和对P53蛋白分子活性的调控。
能够激活P53的外界因素有:
1,DNA损伤
2,强的增殖信号
3,氧化压力
4,缺氧
5,缺少营养
6,缺少核苷酸
7,复制压力
8,端粒损耗
上述这些因素都会增加细胞中P53的浓度,并会促进P53的磷酸化。
P53对下游基因的调控
现在已经知道,P53蛋白直接调控的基因,有129个以上
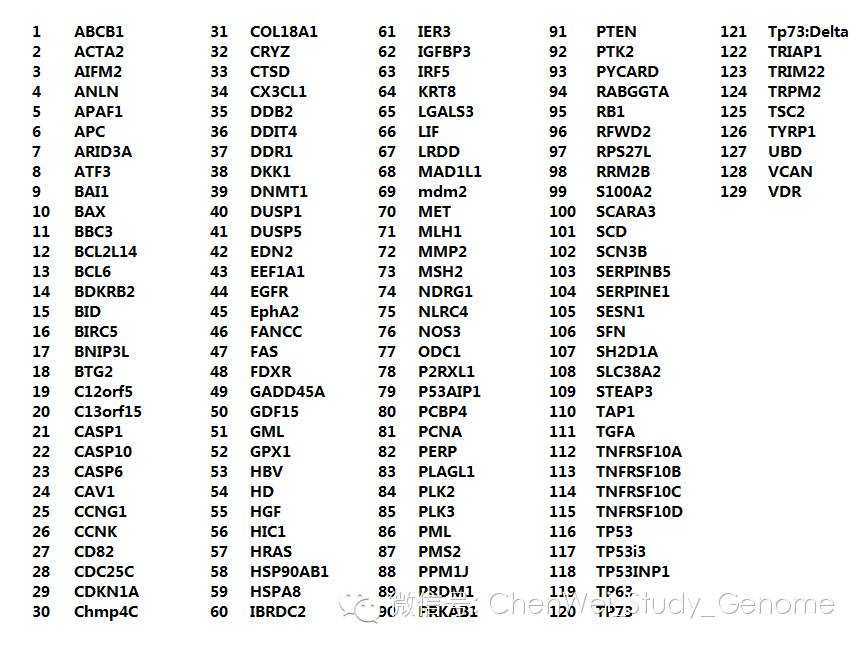
些被调控的基因,按其功能,分成9个大类。前4个大类:
第1个,细胞周期捕获,也就是把细胞阻止在G1期,不让细胞进入到S期
第2,DNA修复
第3,细胞老化
第4,细胞凋亡
第5类,代谢和抗氧化。P53的调控方向是减弱细胞的合成代谢。
第6类,细胞自噬。P53的调控方向是加强细胞的自噬,也就是加强清除细胞内部的垃圾。
第7个,肿瘤的微环境。P53的调控方向,是加强周围的免疫反应、炎症的反应。吸引更多的巨噬细胞、杀伤细胞前来。用一句通俗的话说,叫作“向我开炮”。
第8,细胞的侵袭和转移能力。P53的调控方向,是减弱细胞的侵袭和转移能力。
第9,干细胞功能。P53的调控方向,是阻止干细胞功能。
记得:P53总是把细胞向静止、修复、死亡的方向进行调控。
ALK基因的全名是:Anaplastic lymphoma kinase。翻成中文,是“间变性淋巴瘤激酶”。
ALK位于chr2 短臂上,包含29个外显子,编码一个1620aa 的蛋白质。刚翻译出来是177KD。蛋白的N端被加上糖链,分子量达到200KD。再被转运到细胞膜上。
ALK蛋白是胰岛素受体家族中的一员。ALK蛋白是一个跨膜的、酪氨基激酶的单体。
ALK蛋白的N端露在细胞膜外面,N端的功能是接受外界配体的信号。中间段是跨膜部分。C端位于细胞内,是有酪氨酸激酶功能的结构功能域。
野生的ALK蛋白,2个蛋白单体组成一个ALK的二聚体,经过配体的激活,二聚体的两个亚基之间相互磷酸化,二聚体变成有激酶活性的酪氨酸激酶。
主要有三种突变形式:
第1种,是点突变
第2种,是拷贝数异常增加
第3种,是染色体异位,ALK基因与别的基因形成融合基因
对于ALK基因来说,产生融合基因突变,是很重要的一种致癌基因突变形式。目前已知,ALK会与20多种基因形成融合基因,其中最常见的有2种:
第1种是,EML4-ALK融合基因,,
第2种是,NPM-ALK融合基因
突变的ALK蛋白所参与的激活的下游信号通路十分广泛。现在已知它会参与的信号通路有:
RAS-MAPK通路
PI3K-AKT通路
第3,PLCγ通路
第4,JAK-STAT通路
以及多个其它通路,,这些信号通路,最后都是导向:细胞增殖、抵抗凋亡、促进血管生成,最终会诱发癌症。
标签:编码 his 需要 logs none pop 聚合 gen 融合
原文地址:http://www.cnblogs.com/li-20151130/p/7506952.html