标签:style http color io os ar 使用 for strong
维基百科
http://zh.wikipedia.org/wiki/%E4%BA%BA%E9%A1%9E%E5%85%8D%E7%96%AB%E7%BC%BA%E9%99%B7%E7%97%85%E6%AF%92
http://zh.wikipedia.org/wiki/%E8%89%BE%E6%BB%8B%E7%97%85
其实我比较崇拜HIV病毒,潜入细胞核,注入到宿主基因;进入漫长潜伏期,有选择性杀死淋巴细胞,巨噬细胞;人体免疫力崩溃后,百毒入侵;可谓典型木马战术
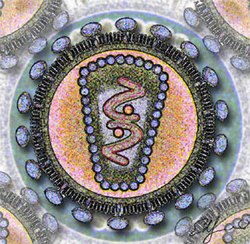 人类免疫缺陷病毒纵切面的形象示意图
|
||||||
| 病毒分类 | ||||||
|---|---|---|---|---|---|---|
|
||||||
| 种 | ||||||
|
人类免疫缺陷病毒(Human Immunodeficiency Virus, HIV)是一种感染人类免疫系统细胞的慢病毒,属反转录病毒的一种。普遍认为,人类免疫缺陷病毒的感染导致艾滋病,艾滋病是后天性细胞免疫功能出现缺陷而导致严重随机感染及/或继发肿瘤并致命的一种疾病。艾滋病自1981年在美国被识别并发展为全球大流行至2003年底,已累计导致两千余万人死亡。人类免疫缺陷病毒通常也俗称为“艾滋病病毒”或“艾滋病毒”。
人类免疫缺陷病毒作为反转录病毒,在感染后会整合入宿主细胞的基因组中,而目前的抗病毒治疗并不能将病毒根除。在2004年底,全球有约四千万被感染并与人类免疫缺陷病毒共同生存的人,该年并有三百余万人死于艾滋病;流行状况最为严重的仍是撒哈拉以南非洲,其次是南亚与东南亚,但该年涨幅最快的地区是东亚、东欧及中亚。
在人类免疫缺陷病毒感染病程的一些时期,特别是早期及末期,具有感染性的病毒颗粒会存在于含有免疫细胞、血浆、淋巴液或组织液的某些体液中,如血液、精液、阴道分泌液、乳汁、唾液或伤口分泌液;另一方面,病毒在体外环境中极不稳定。因此,人类免疫缺陷病毒的传播途径主要是不安全的性接触、静脉注射、输血、分娩、哺乳等;而通常的工作、学习、社交、或家庭接触,比如完整皮肤间的接触、共用坐便器、接触汗液等,不会传播人类免疫缺陷病毒;与唾液或泪液的通常接触(如社交吻礼或短暂接吻)也未有导致传播人类免疫缺陷病毒的报告;但美国疾病控制与预防中心说已感染病毒的母亲,可将病毒透过先嚼过的食物(唾液内含血液)传给孩子。[1]
艾滋病最早是于1980年代初期在美国被识别,早期的病人都是年轻的男同性恋者,因此艾滋病一度被称作同性恋病,受到当时里根保守政府的忽视。但在美国疾病控制与预防中心以及有识的医生与科学家的持续工作下,累积了信服性的流行病学数据,显示艾滋病有一定的传染性致因(etiology),同时,因输血导致非同性恋者罹患艾滋病的病例逐渐增多,许多科学家开始调查此传染性病原。
在巴黎巴斯德研究所专门研究逆转录病毒与癌症关系的法国病毒学家吕克·蒙塔尼及其研究组于1983年首次从一位罹患晚期卡波西氏肉瘤的年轻男同性恋艾滋病人(首字缩写LAI)的血液及淋巴结样品中,分离到一种的新的反转录病毒;他们发现这种病毒不同于人类T细胞白血病病毒(Human T cell Leukemia Virus, HTLV),而是一种慢病毒,他们将之命名为“免疫缺陷相关病毒”(Immune Deficiency-Associated Virus, IDAV)。大西洋另一边,蒙塔尼埃当时的合作者,美国国家癌症研究所的美国生物医学科学家罗伯特·加罗(Robert Gallo)及属下也从一些细胞株系中分离到新病毒,并将之命名为“IIIB/H9型人类T细胞白血病病毒”(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加罗小组首次于1984年在《科学》期刊发表论文,论证了这种新病毒与艾滋病的病原关系。
随后加罗前往法国,提供HTLV-IIIB/H9以与蒙塔尼埃的IDAV (LAI)比较,结果两株病毒是完全一样的。本来双方约定共同举行新闻发布会,但已经知情的美国健康与人类服务部(Department of Health and Human Services, DHHS)部长玛格理特·海克勒(Margaret Heckler)紧急电召加罗回国,单方面举行了新闻发布会。DHHS指示加罗尽速开发在血液中检测人类免疫缺陷病毒的技术并申请专利,以方便美国的制药公司在全球销售这一技术,加罗使用了这种HTLV-IIIB/H9病毒。法美两国以及双方的科学家为此有若干年的争议与官司,一直无解;持续到1991年,双方才达成某些程度的谅解。
1986年,该病毒的名称被统一为“人类免疫缺陷病毒”(Human Immunodeficiency Virus, HIV),以更明确的反映出病毒导致免疫缺陷而不是导致癌症的性质。
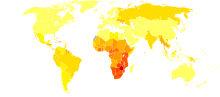
根据世界卫生组织的HIV/AIDS统计报告,在2004年,全球估计有四千万人(3590至4430万人)与人类免疫缺陷病毒相伴生存(被感染),其中五百万人(430至640万人)属于新发感染病例,另外,有三百万人(280至350万人)死于艾滋病。这些数字并在不断增长中,其中,东亚、东欧、中亚等地区涨幅最快。感染最严重的地区仍然是撒哈拉以南非洲,其次是南亚与东南亚。
人类免疫缺陷病毒(HIV)属于慢病毒属,是一种潜伏期极长的逆转录病毒。HIV分为两型:HIV-1与HIV-2。多数国家的HIV感染是由HIV-1造成的,并且感染HIV-1后超过90%的患者会在10-12年内发病成为艾滋病;HIV-2主要分布在西部非洲,其感染往往没有相关的病症。

HIV-1与HIV-2两者都来自非洲中西部,并从灵长类动物传到人类。HIV-1可能是从黑猩猩的猴免疫缺陷病毒跨种感染进化而来;HIV-2则可能是从几内亚比绍的乌黑白眉猴(Sooty Mangabey, Cercocebus atys)的另一种猴免疫缺陷病毒跨种感染而来。
人类免疫缺陷病毒直径约120纳米,呈二十面体。病毒外膜是磷脂双分子层,来自宿主细胞,并嵌有病毒的蛋白gp120与gp41;gp41是跨膜蛋白,gp120位于表面,并与gp41通过非共价作用结合。向内是由蛋白p17形成的球形基质(Matrix),以及蛋白p24形成的半锥形衣壳(Capsid),衣壳在电镜下呈高电子密度。衣壳内含有病毒的RNA基因组、酶(逆转录酶、整合酶、蛋白酶)以及其他来自宿主细胞的成分(如tRNAlys3,作为逆转录的引物)。
病毒基因组是两条相同的正股RNA,每条RNA长约9.2-9.8kb。两端是长末端重复序列(long terminal repeats, LTR),含顺式调控序列,控制前病毒的表达。已证明在LTR有启动子和增强子并含负调控区。LTR之间的序列编码了至少9个蛋白,可分为三类:结构蛋白、调控蛋白、辅助蛋白。
人类免疫缺陷病毒感染多种细胞,包括CD4阳性辅助T细胞与巨噬细胞等在表面表达CD4分子的细胞。病毒进入辅助T细胞或巨噬细胞不仅仅是透过病毒颗粒被膜的糖蛋白gp120与被感染细胞的CD4分子之间的相互作用来介导,而是同时需要宿主细胞表面的趋化因子受体来作为协同受体。嗜M(巨噬细胞)型(macrophage (M)-tropic)人类免疫缺陷病毒(或称做“非合胞诱导型株”,non-syncitia-inducing strains, NSI)利用乙类趋化因子(beta-chemokine)受体CCR5进入细胞,因而可以在巨噬细胞与CD4阳性辅助T细胞中复制。嗜T型(T cell (T)-tropic)人类免疫缺陷病毒(或称做“合胞诱导型株”,syncitia-inducing strains, SI)使用甲种趋化因子(alpha-chemokine)受体,因为主要在CD4阳性辅助T细胞中复制,尽管也可以在巨噬细胞中复制。仅使用CCR5受体进入细胞的病毒,称为R5;仅使用CXCR4受体的,称为X4;两者都使用的,则称为X4R5。当然根据协同受体分型并不一定区分病毒的实际细胞嗜性。
人类免疫缺陷病毒也可感染树状细胞。
糖蛋白gp120与其协同受体及CD4分子的相互作用,引发gp120蛋白构象的改变,从而将跨膜糖蛋白gp41原本深埋的部份曝露,进而使gp120的V3环接近协同受体,然后gp41导致病毒被膜与靶细胞膜的融合,使病毒核衣壳进入细胞。gp41导致细胞膜融合的具体机制仍未明了。
有些人群对HIV有较高的抵抗力(但并不是完全抵抗),是因为他们的细胞缺少HIV进入细胞的一个协同受体(co-receptor),这个协同受体是趋化因子受体CCR5。他们的CCR5基因有一段长为32碱基对的缺失(deletion),造成产物蛋白严重截断(truncated),不能在细胞表面探测到。这些人主要分布在欧洲,也有分布在中东及印度次大陆。
HIV作为病毒,必须进入细胞才能继续其生活史(整合、复制、释出…)及感染史。病毒透过其表面的gp120糖蛋白与靶细胞表面的细胞分化抗原(或称分化簇)CD4分子作用,与靶细胞的细胞膜融合并进入细胞。这个过程需要靶细胞表面的一个七次跨膜的G蛋白耦联受体,目前发现的主要为趋化因子受体CCR5(嗜M的病毒株)及CXCR4(嗜T的病毒株)。
具有该CCR5缺失的人,因为细胞表面不表达CCR5,使部分HIV不能进入并感染这类细胞。但HIV可以透过其他协同受体感染这类细胞,或者其他类型的细胞不需要此CCR5就可以被感染,所以这些人并不能完全抵抗HIV。事实上,已有该CCR5缺失的纯合个体感染HIV的病例报告。
病毒核衣壳一旦进入细胞,病毒的逆转录酶就将病毒的单链正意RNA从病毒蛋白上释放,并根据正意RNA逆转录生成反意互补DNA(cDNA)。这个反转录过程非常容易出错,因此这是病毒进行突变(如,获得抗药性)的重要步骤。然后,根据cDNA合成双链的病毒DNA(vDNA)。新的病毒DNA被转运到细胞核中,并由病毒的整合酶将其整合到宿主的基因组上。这样,病毒完成感染开始进入潜伏期。
要启动病毒,细胞中需要存在一些转录因子。最重要的一种叫做NF-κB,存在于所有被启动的T细胞中。这就意味着,最容易被人类免疫缺陷病毒杀死的细胞,恰恰是那些正在参与感染作战的细胞。
HIV选择性地侵犯带有CD4分子的细胞,主要有T4淋巴细胞、单核巨噬细胞、树突状细胞等。细胞表面CD4分子是HIV受体,透过HIV囊膜蛋白gp120与细胞膜上CD4结合后由gp41介导使毒穿入易感细胞内,造成细胞破坏。
gp120是HIV病毒的衣壳蛋白,由基因env编码,其分子量为120KD。在病毒侵入人体T细胞的过程中发挥重要的作用,同时它还存在游离态的形式,透过一种类似于超抗原作用的途径,在体内非特异性地启动一些主要的免疫细胞,从而大大增强了HIV对人体的危害作用。
在HIV侵入人体的过程中,表达在病毒表面的gp120使HIV病毒轻易地结合于特定的T淋巴细胞上,然后透过病毒蛋白外壳与T细胞膜的融合,从而达到浸染T细胞的目的。此外,游离于体内的gp120透过其特殊的超抗原作用启动过量的T细胞,并且刺激体内其他免疫细胞发生一系列反应,大大降低了人体的免疫功能。现在有关gp120的研究正逐步深入,可以预见在不久的将来gp120会成为AIDS免疫治疗中的靶分子。
艾滋病病毒难以对付的原因有几个。第一,艾滋病病毒是一种RNA病毒,它会使用逆转录酶把RNA整合到细胞的DNA中。在此之间,它有大量突变的机会。因此,病毒很快会对疗法产生抵抗力。第二,通常认为的艾滋病病毒是T细胞杀手的想法是不正确的。如果艾滋病病毒是杀手病毒的话,它很快就会死亡,因为没有更多的时间感染新的感染者。通常,艾滋病病毒都会在人体存活数年,在病人不知情的情况下透过性行为或血液交换进行传播。艾滋病病毒甚至在药物杀死了血液中所有的细胞后仍能幸存。它把自己整合在寄主细胞的DNA中,保持数年的休眠状态,免疫系统不会对其作出反应,因为它只是DNA片段。当细胞分裂和复制的时候,病毒被一起复制。数年后,病毒会变得活跃起来,夺取对细胞的控制和开始复制。在近几年,那种CD4+ T细胞是直接由于HIV感染而减少的观念也受到质疑。艾滋病病毒的蛋白质糖衣受到病毒微粒的驱动,使得血液中充满这些蛋白质,它会粘住CD4+ T细胞,把它们黏合在一起。另一方面,这些细胞被免疫系统识别,并引起免疫反应,使得免疫系统杀死自己的CD4+ T细胞。总之,艾滋病病毒就像一个擅长游击战的恐怖主义份子,当被威胁时保持低调及寻找避难所,而一旦当它被免疫系统忽视就随时在被伤害的地方反攻。
| 感染途径 | 估计感染几率 | |||
|---|---|---|---|---|
| 输血 | 90%[4] | |||
| 分娩(传给胎儿) | 25%[5] | |||
| 注射性毒品使用共用针头 | 0.67%[6] | |||
| 经皮针扎 | 0.30%[7] | |||
| 肛交受方* | 0.50%[8][9] | |||
| 肛交插入者* | 0.065%[8][9] | |||
| 阴茎阴道交媾女方* | 0.10%[8][9][10] | |||
| 阴茎阴道交媾男方* | 0.05%[8][9] | |||
| 口交接受者 *§ | 0.01%[9] | |||
| 口交插入者*§ | 0.005%[9] | |||
| * 假设未使用安全套 § 资料指的口交 是男性作出的 | ||||
爱滋病毒是透过交换体液来传播的,特别是精液和血液。
最常见的传染途径是:进行阴道或肛门性交,共用沾污了的针筒,受病毒感染的母亲传播给婴儿。
另外,亦有越来越多个案显示,感染了病毒的母亲可经喂母乳而把病毒传给婴儿。
任何带有足量病毒的体液交换。
避孕套可大幅降低感染HIV的机率,但亦非天衣无缝。
2009年9月,在泰国进行的一项由美国军方支持的医疗试验发现,某实验性疫苗能将感染艾滋病毒的风险大大降低。人类首次获得了具有一定免疫效果的艾滋病疫苗[11]。
通常是发生伺机性感染的疾病,如卡波西氏肉瘤、肺囊虫肺炎,才被发现。此外还会出现体重急遽减轻。持续发烧。淋巴腺肿大等症状。会入侵人类免疫细胞并加以破坏。
实验室检验人类免疫缺陷病毒感染主要分成两阶段, 第一阶为筛检法,利用酵素免疫法(Enzyme immunoassay, EIA)、微粒凝集法(Paraticle agglutination)或快速筛检法(Rapid test)做初步检测,因伪阳性率甚高,因此若筛检为阳性时应再以第二阶段的确认试验做确诊,确认试验主要有西方墨点法(Western blot)、核酸分析法(Nucleic Acid Testing, NAT)和p24抗原中和试验(Neutralization test)。
其中,酵素免疫法(Enzyme immunoassay, EIA)目前已发展到能同时检测抗体和病毒p24抗原的第四代检验试药,即疾病管制署所称的爱滋抗原/抗体复合型检测(HIV antibody and antigen combination assay)筛检,能大幅缩短空窗期至一到二星期,在台湾,使用复合型检验法的实验室于2012年已经达56.3%之多。
若非使用爱滋抗原/抗体复合型检测法来检验是否感染爱滋病毒,则需等到抗体产生后才能经由筛检法验出,感染至抗体产生的期间称作空窗期,平均约是二到八周,0.1%以下比例的少数人会大于这个时间,目前国际间的共识约是十二周。
或是可以使用RT-PCR等方式检测血中是否带有病毒的RNA/DNA作为诊断,此方法的空窗期约七至十四天,一般建议为二十八天。但是费用较为昂贵。
今天病人通过服用不同的药物攻击在不同的阶段艾滋病病毒。这些药物包括:
建立对HIV疗法的课题面临很多困难。每一种有效的药物都有副作用,通常是严重的或是致命的。常见的副作用包括严重的恶心、腹泻、肝脏的损毁和衰竭、黄疸、高血脂、糖尿病、脂肪组织移位、贫血、肾结石。致命的副作用包含史蒂芬斯-强森综合症、猛暴性肝炎、胰脏炎、乳酸血症。每一种疗法都要求经常性的血液检查以确定疗效和肝脏功能。
如果不进行治疗,根据HIV不同亚型,感染艾滋病毒后的的净存活时间平均为9至11年,而诊断为AIDS之后,如果在资源受限导致无法治疗的情况下,根据不同的研究表明,平均存活时间在6至19个月之间。而在医疗资源充足的地区,用高效抗逆转录药物(HAART)的作为有效治疗手段治疗HIV感染者和AIDS患者,可以让死亡率减少80%,并能将新诊断出的HIV感染者的寿命延长最少30年。
随着新的治疗办法不断被研发出来,并且由于HIV持续演化出对这些药物的抗性,对于存活时间的估计可能继续改变。如果没有抗逆转录疗法,患者通常在病情诊断为已发展成AIDS后1年死亡。大多数患者因为免疫系统的持续失效而死于机会性感染或者恶性肿瘤。临床疾病的发病率因为个体的不同而呈现巨大差异,已有研究表明其受许多因素的影响,例如宿主的易感染性和免疫功能,保健措施和交叉感染,以及特定病毒品种的影响。
获得性免疫缺陷综合症(或称后天免疫缺乏综合症,英语:Acquired Immune Deficiency Syndrome, AIDS,音译为爱滋病或艾滋病[1]),是一种由人类免疫缺乏病毒(简称HIV)的反转录病毒感染后,因免疫系统受到破坏,逐渐成为许多伺机性疾病的攻击目标,促成多种临床症状,统称为综合症,而非单纯的一种疾病[2],而这种综合症可通过直接接触黏膜组织(mucosa)的口腔、生殖器、肛门等或带有病毒的血液、精液、阴道分泌液、母乳而传染[3][4],因此各种性行为、输血、共用针头、毒品的静脉注射都是已知的传染途径。另外所有带有创伤性(比如洗牙和补牙,甚至是纹身[5])的和需要进入人体内部的医疗检查(比如肠镜和胃镜),如果医疗器械消毒不彻底,则都有病毒交叉感染的可能。
1981年6月6日,美国疾病控制与预防中心通报全球首宗艾滋病毒感染案例,自此人类便展开了与这头号传染病的漫长抗争。在艾滋病面世初期,医学界对这病了解不多,苦无医治对策,染病者只好受折磨至死。直至1995年终首现曙光,鸡尾酒疗法的发明与广泛应用均延缓了大多数感染者的发病时间,使死亡率开始大幅下降。及至21世纪10年代,科学家仍在进行大量研究与临床实验,以祈尽快找出能彻底根治的方法。多数学者认为人类免疫缺乏病毒是20世纪从撒哈拉以南的非洲地区蔓延开来,至今已成为全球性的大流行病 [6],而根据联合国艾滋病规划署和世界卫生组织统计,自1981年首度证实以来,AIDS已夺取超过3,000万人[7] 的性命,使它成为史上最具破坏力的流行病之一,截至2011年6月底世界上约有6,400万人[7] 感染艾滋病毒,每天平均有7,000宗[7] 新病例。而在2005年便造成约300万人死亡,当中约57万是儿童,三分之一的死亡案例发生在非洲撒哈拉以南,间接造成经济发展迟缓以及人力资本的匮乏,超越了疾病本身的层次,后天免疫缺乏综合症使得社会议题更加棘手[8]。根据统计,每天有1800名新生儿一出生就感染上艾滋病毒,45%的感染儿童在2岁之前死亡。尽管目前研制的药物能够抑制病毒的活性、减缓病程发展,间接减少感染后的死亡率和发病率(morbidity),但是并非所有国家都有能力取得这些药物,这种情况在发展中国家更为严重,当地却同时是后天免疫缺乏综合症患病率(prevalence)较严重的地区[9],且事实上仍未有任何药物获得证实能根治艾滋病,因此艾滋病目前已是全世界疾病监测(surveillance)的重要指标之一,各国政府也透过立法试图控制传染的规模并借由各种教育宣传手段,增加全人类对该疾病的认识。
HIV病毒分为两种:HIV-1,HIV-2。HIV-1是其中较为流行的一种。HIV-2则基本只存在于西部非洲部分地区。HIV-1的毒性与传染性均高于HIV-2。HIV和其它在很多灵长类动物中发生的引起类似艾滋病的病毒有密切关系,并曾一度被认为是在二十世纪初期从动物传染给人类的,尽管有一些证据表明在更早的一些个别案例中可能已经有艾滋病在传播了。但是传播的具体的动物源、时间和地点(或者有多少传播来源)都是未知的。与人类相同的HIV病毒在非洲的小人猿(黑猩猩)中都有发现,但这并不能证明人类身上的HIV病毒最早来源于黑猩猩,或人类和黑猩猩的HIV病毒是从第三方获得的。
普遍认为,人类免疫缺陷病毒的感染导致艾滋病。艾滋病是后天性细胞免疫功能出现缺陷而导致严重随机感染及/或继发肿瘤并致命的一种疾病。艾滋病自1981年在美国被识别并发展为全球大流行至2003年底,已累计导致两千余万人死亡。人类免疫缺陷病毒通常也俗称为“艾滋病病毒”或“艾滋病毒”。 后天免疫缺乏综合症患者所遭遇严重的病理呈现,主要源自于人类免疫缺乏病毒的感染。此病毒属于一种反转录病毒,主要针对人类免疫系统重要的组成进行感染并改变其运作模式,包括辅助型T细胞、巨噬细胞、和树突细胞(dendritic cell)等,其中又以直接破坏细胞膜上具有CD4辨识蛋白特征的T细胞(简写作CD4+T细胞)的结果最为严重,因为CD4+T细胞是人体免疫系统辨识外来物质过程中,不可或缺的元素之一,一旦CD4+T细胞受到感染而不表现CD4辨识蛋白,或甚至造成此种细胞死亡,导致每微升血液中CD4+T细胞数量低于200时,细胞免疫(cellular immunity)就几乎完全失去功能,进而导致平时不易感染健康人类的微生物得以大肆入侵,由于受HIV感染个体无法有效分辨敌我,最后导致严重的各种感染症,总称后天免疫缺乏综合症[10]。
根据流行病学统计,在未使用抗反转录病毒药物治疗的情况下,自感染病毒至出现症状的潜伏过程的中位数约为9至10年,自正式出现后天免疫缺乏综合症起算,存活时间的中位数亦仅有9.2个月[11] 然而,临床观察到的疾病进程速度受到许多因素影响,在个体之间有很大的变异,短则两周、长可达20年。这些因素甚至也包含了艾滋病毒所攻击的免疫系统总体状况,因此从感染开始到发病,甚至其变化程度,都一直受到感染者免疫力和病毒活动之间的互动所影响[12][13]。举例而言,一般年长者免疫力较差,因此相对于年轻患者而言,病程发展迅速的风险较高;医疗的品质和同时存在的感染症(如结核)也会使得HIV感染者处于较为不利的状态[11][14][15]。
此外,遗传也左右了感染过程和感染后的状况,有些人因带有编号为CCR5-Δ32的突变基因,对特定的HIV病毒株具有抵抗力[16]。更有研究指出,罗马帝国子民后代更易感染HIV:在西班牙、意大利和希腊这些长期处于罗马帝国核心的地方,他们的CCR5-delta32基因出现率为0%-6%。而在罗马帝国边疆地区、比如英格兰和德国,这种基因出现率则是8%-11%。那些从来没有被罗马占领过的国家,CCR5-delta32基因出现率更高。该基因变异的频繁度,正与古罗马版图的变迁吻合 [17]。此外,由于HIV病毒本身在演化过程中亦会产生变异,不同品系也可引起不同程度的临床表现[18][19][20]。
艾滋病毒属滤过性病毒,由于其体积极为微小,现有的检测方法不能准确检出病毒存在,但身体会自然产生抗体对抗病毒,抗体增长在一段期间后将达至可被验出的水平,这段期间称为空窗期,由两星期(最快)至三个月不等,亦有个别例子长达六个月,世卫及多数国家政府则采用三个月为准。在空窗期间接受爱滋抗体测试,有机会呈假阴性反应,因此必须等待怀疑受感染日起计最少三个月后接受测试,才可得出较准确结果。亦有少数发达国家(如日本)采用抗原抗体联合检测方法并规定此方法的空窗期为两个月(60日)。艾滋病毒抗体测试一般以抽取血液为主,有个别机构则采用尿液样本化验。以往,血液测试报告需等候一天至数天不等,自从民间团体引入新兴的快速测试后,爱滋抗体血液结果缩短至几分钟至十多分钟不等。除到指定政府机构、民间志愿团体或私立化验所接受艾滋病抗体测试外,亦可自行到医疗网站订购价钱大众化的艾滋病自我检测器。若测试结果证实为阳性,则必须尽快到政府艾滋病专科就诊及定时服药,切勿延误医治。
自1981年发现艾滋病以来,流行病学专家曾提出各种不同的定义,以监测疾病扩散情况,例如1985年的班基定义(Bangui definition)和1994年世卫艾滋病例扩充定义(1994 expanded World Health Organization AIDS case definition),然而临床上对病人的分级诊断却因为该定义的检测效果不佳,因而未能大量采用。在发展中国家,世界卫生组织采用临床表现和实验数据作为分级依据,而在发达国家中,则主要采用美国的分类系统。
染上艾滋病毒后至病发的潜伏期由几个月(最快)至10年或以上不等[22],根据病情的发展过程,临床上分为三期:
艾滋病病毒进入人体后,会很快进入急性感染期。病毒快速繁殖,每毫升血液中的病毒含量可达数百万,同时CD4+细胞数量也会显著下降。随后,CD8+细胞开始活动,杀死被感染的细胞,免疫系统也开始产生抵抗艾滋病病毒的抗体。CD8+细胞的活动被认为是控制病毒水平的要素之一。如果它们反应强劲,就可以延缓病程,但是并不能清除所有病毒。CD8+细胞活动逐渐减弱消失后,CD4+细胞的水平也恢复到每微升800左右(正常值是1200左右)。在这个阶段(通常是感染后的2~4周),大多数病例都会产生类似流感或者单核血球增多症的病症,这被称作急性HIV感染。常见的症状包括发烧,淋巴结病症,咽炎,皮疹,肌肉疼痛,疲乏,口腔溃疡,还可能包括头痛,恶心,呕吐,肝/脾肿大,体重下降,鹅口疮,神经系统病变等。每个病例的具体症状各有不同,每种症状是否发生皆有可能。这些症状的持续时间平均约28天,通常至少要有一周。因为这些症状没有特异性,所以经常未被认为是感染了艾滋病病毒的征兆。甚至病人就医时医生亦可能误诊为有相似症状的,其他更常见传染病。因此,这些症状并不能作为确诊艾滋病病毒感染的依据。但是遇到这些症状时仍然需要格外小心。因为病人此时血液中的病毒含量很高,他们的传染性非常强。
艾滋病急性期症状至少高危行为后的第三天才会有部分出现,而这种症状不会发生在高危的10周以后,绝大部分人出现急性症状的时间是在10-14天,持续时间1到2周,而需要知道的是有10%以上的艾滋病感染者初期是不出现急性期症状的。
艾滋病感染者出现初期症状的比例:[23]
免疫系统的强烈反应抑制病毒活动,并能减少血液中的病毒数量。从此病人进入艾滋病的临床潜伏期。潜伏期的长度受很多因素的影响,最短可能仅有两周,最长可达20年。通常在临床潜伏期,病人没有任何可见症状。在早期,病毒通常藏身于淋巴结内。 由于CD4+细胞是艾滋病病毒的主要靶细胞之一,同时亦在免疫系统中占有关键地位,因此除了病毒含量,CD4+细胞数也是监测病程的重要指标。通常一旦每微升血液中的CD4+细胞数少于200时,或者CD4+细胞在淋巴细胞中所占比例少于14%时,细胞免疫机能已经难以维持,病人即将进入发病期。
病人出现腹股沟淋巴结以外的两处以上不明原因的淋巴结肿大持续3个月以上,并出现全身症状,如无故发热、疲劳、食欲不振、消瘦、体重下降、睡眠时冒汗等,至少有以上两种症状及经血液测试,即可诊断为艾滋病相关综合征。一部分人停留在这种状态,而另一部分病人则发展为严重的艾滋病。
有些带原者的病征阶段并不明显,可能直接进入病发阶段。突出表现为致病性感染,当免疫力越来越差,CD4细胞可能少于200个/血液微升时,病人就会开始出现艾滋病并发症,如伺机性感染,正式进入了后天免疫不全综合症,也就是艾滋病,进入这阶段的病人一般不会存活超过九个月,然而医学的进步,存活的时间也可能延长。其中包括原虫、真菌、病毒、细菌感染,恶性肿瘤的发生等,根据香港卫生署的数字显示[24],最常见可被界定为艾滋病发的并发症依次序为肺囊虫肺炎、结核病、真菌感染、马尔尼菲青霉菌、卡波西氏肉瘤、分枝杆菌、巨噬细胞病毒等。
| 感染途径 | 估计感染几率 | |||
|---|---|---|---|---|
| 输血 | 90%[26] | |||
| 分娩(传给胎儿) | 25%[27] | |||
| 注射性毒品使用共用针头 | 0.67%[28] | |||
| 经皮针扎 | 0.30%[29] | |||
| 肛交受方* | 0.50%[30][31] | |||
| 肛交插入者* | 0.065%[30][31] | |||
| 阴茎阴道交媾女方* | 0.10%[30][31][32] | |||
| 阴茎阴道交媾男方* | 0.05%[30][31] | |||
| 口交接受者* | 0.01%[31] | |||
| 口交插入者* | 0.005%[31] | |||
| * 假设未使用安全套 | ||||
艾滋病毒其实脆弱,一旦暴露于空气中(离开人体)便会很快死亡,因此艾滋病完全可以通过下面的措施来预防。已知的艾滋病感染途径就是体液交换及没有全程正确使用安全套。 带有艾滋病血液(针筒上的血液)在空气中不能立即死亡,浓度愈高生存时间愈长,长的则可达三日,即使浸在酒精消毒也能生存十分钟。
艾滋病的主要传播途径有血液传播、母婴传播及性传播,因此可通过下列途径预防艾滋病:
降低经性途径感染艾滋病病毒风险的方法: [33] 应每次性行为均做足安全措施(如全程使用安全套、避免接触对方体液等)
目前,医学界并没有任何可以治愈艾滋病和人类免疫缺陷病毒(HIV)的方法,也没有可行的疫苗。目前美国食品药品监督管理管理局(FDA)已批准二十多个药物用于AIDS的治疗,但所有的治疗方法都只能减慢或抑制病毒在体内的扩散[34],并不能有效地清除患者体内的人类免疫缺陷病毒(HIV),而且这些药物价格昂贵,且有较强的毒副作用,会诱发病毒耐药株的产生。
自美国于1981年发现新型疫症艾滋病以来,从没有一种药物或疗法能有效降低死亡率,每年全球的死亡人数有增无减,就像“绝症”般,一旦染上便会被人排斥远离及只能等待死亡的降临,受尽歧视及痛苦。但到1995年,出现了突破性转机。台裔美籍科学家何大一博士发明了鸡尾酒疗法,虽然并非彻底根治,但成功大幅减低死亡率,将发病时间无限期推迟,也使感染者体内的病毒数可以降低至无法验出的状况,从而大幅改善带原者的健康,不过鸡尾酒疗法对有些感染者有强烈的副作用,医学界均认为艾滋病尚不能称之为可以治愈的疾病。
这项研发使何大一以“艾滋病研究者”(AIDS Researcher)的身分荣获1996年的《时代杂志》年度风云人物。
预防艾滋病的疫苗仍在研制中,但进展很慢。至今,还没有一种有效的治疗方法可以完全治愈艾滋病,每年仍有大量的病患死于艾滋病,特别是在缺乏有效疗法和药物的第三世界国家(如非洲)的患者。现在昂贵的艾滋病的治疗方法主要针对HIV病毒,目前仍未证实在治愈方面有效。艾滋病发病期产生的各种机会感染,有些可以对症下药地治疗,或者在感染发生前就进行预防性治疗,但也有些机会感染很难治疗。
2005年11月,据英国广播公司及一些报章称:一名25岁的伦敦男性居民安德鲁·斯丁普森(Andrew Stimpson)曾在2002年5月确诊感染艾滋病病毒,但未进行任何药物治疗,在2003年10月检查时发现病毒已经消失。但负责治疗斯廷普森的切尔西和威斯敏斯特全民保健系统基金仍要求斯廷普森接受进一步检查,他有可能是第一位自己痊愈的HIV感染者。[35][36]
另据美国媒体2008年11月12日报道,一名同时患有白血病和艾滋病的患者在接受干细胞骨髓移植手术后,体内的HIV病毒居然也全部消失了。治愈这名美国男子的许特曼博士是血液学专家,而非艾滋病专家。他在准备骨髓移植手术的过程中想起一篇论文,文中称一些人携带的一种突变基因似乎能让他们先天具有抵御艾滋病病毒的能力,这种自双亲遗传的基因称为“德尔塔32”,能够阻碍艾滋病病毒对人体健康细胞的侵袭。许特曼博士便开始寻找携带这种基因、且能与患者骨髓相配型的捐献者。结果在80名骨髓配型成功的捐献者中,第61人被检测出带有“德尔塔32”突变基因。找到合适的配型者后,患者还在医生的指导下进行了一系列准备事宜。他服用了一些效力强劲的药物,接受了放射性治疗,目的在于消灭其自身受到感染的骨髓细胞,使其免疫系统丧失功能。此外手术结束后,许特曼博士还停止给患者服用抗艾滋病的药物,因为研究小组担心,这些药物会干扰新骨髓细胞的生长。美国全国免疫疾病和传染病研究所主任安东尼·福奇博士表示,这种手术如果用作临床治疗的话费用太高,而且风险过大,但还是值得鼓励。许特曼博士则表示目前不能过于乐观。他说:“藏匿于体内的艾滋病毒有时很狡猾,未被杀清的病毒伙粒就会找机会再冒出来。”[37]
2008年1月,瑞士科学家认为患者接受抗逆转录病毒药物治疗,压制住血液中的病毒后,可能不会通过性途径继续传播病毒[38]。
2011年6月,有报道指美国人布朗于1995年感染艾滋病毒,后来患上血癌,接受德国柏林的一个医疗团队进行的骨髓移植后,发现艾滋病毒消失了,包括多处病毒可能螯伏的组织。[7]在接受五年的治疗后,住在美国加州的布朗体内依然没有任何HIV的迹象,在此期间他没有服用任何抗病毒药物。[来源请求]医生特意利用CCR5基因有缺陷的骨髓进行移植而取得成功,然而使用同样方法治疗艾滋病仍然是高风险及高成本,而且找到CCR5基因有缺陷又适合移植给某人的骨髓也不容易。[39]
2012年7月,波士顿布莱根妇女医院的研究员发现,两名患淋巴瘤的 HIV带原者,接受压抑 HIV的抗逆转录病毒药物治疗期间,进行骨髓移植后,两人体内血液细胞的 HIV基因竟开始消失,逐渐被捐赠者的健康细胞杀死和取代,完全消灭。两人情况与全球首名藉骨髓移植根治 HIV的病人布朗相似,但两人移植的是正常细胞,有别于布朗的经挑选可抵抗 HIV的基因突变细胞。
此外,媒体曾多次报道全球的科研人员已发现多种可有效医治、甚至根治艾滋病的方法,现正进行一连串临床测试,可算是给艾滋病携带者的一线曙光,包括:

2007年:
6月,德国科学家宣布成功从人类细胞中分离出艾滋病毒(HIV),令细胞再次变得健康。艾滋病毒可被一种叫Tre的酶“剪走”,然后恢复健康,2010年前会在老鼠身上进行试验,预计2017年前会找出根治艾滋病的方法。[40]
2009年:
6月,加拿大蒙特利尔大学则发现或可彻底治愈艾滋病的方法,使用现时治疗癌症的化学疗法,可将藏在免疫系统记忆T细胞内的艾滋病毒一并杀死,故建议结合化疗及鸡尾酒疗法同时对付艾滋病。[41]
9月,美国和泰国研究人员共同宣布,双方合作开发试验的一种“联合疫苗”可将人体感染艾滋病病毒的风险降低31.2%。[42]
12月,
2010年:
2月,
3月,
12月,德国研究员正研发一种针剂名为“VIR-576”的高效艾滋病药物,试验证实能减少患者血液内95%的艾滋病毒。该药原理是先行占据了艾滋病毒用作依靠的蛋白质肽,不让病毒潜藏,从而避免病毒进一步入侵人体免疫细胞。[52]
2011年:
5月,美国研究人员研制艾滋病疫苗取得重大突破,研究人员给24只恒河猴注射实验性疫苗,疫苗含有一种大部份人体内都有的巨细胞病毒(CMV),它的作用是当艾滋病毒最初进入体内,处于最脆弱的时候,立即启动免疫系统攻击病毒。猴子注射疫苗后,有效控制体内艾滋病毒逾一年,而且病毒更逐渐被清除,研究人员希望3年内研制出用于人体测试的艾滋病疫苗。[53]
2013年:
3月,美国圣路易华盛顿大学医学院研究发现,蜜蜂毒液可以杀死爱滋病毒。这项发现为研发预防爱滋涂剂,甚至是爱滋疫苗铺路。[54][55]
9月,美国奥勒冈健康与科学大学,研究团队发现,动物实验发现,利用新型疫苗、可以有效杀死“猕猴免疫缺乏病毒”SIV,而这种病毒比人类免疫缺乏病毒HIV,还要毒十倍,为人类艾滋病治疗带来一线希望。以巨细胞病毒CMV当载具、做成SIV抗原疫苗,并以模拟性行为方式,先给16只猕猴接种疫苗,再让它们感染SIV病毒,然后观察24到30周后,人道牺牲、解剖发现,有九只猕猴以DNA序列检查,完全验不出SIV病毒,显示疫苗可以清除SIV病毒。[56]
2011年9月,英国研究人员移除艾滋病毒外套膜内的胆固醇后,发现病毒会失去攻击人体免疫系统的能力,人员估计可依循此方向,研究能预防病毒的疫苗。[57]
2013年5月,香港大学研究出一种新型疫苗,成功令带有艾滋病的小老鼠产生大量及有效针对艾滋病病毒的CD8+T细胞。以清除体内受病毒感染的细胞,并产生保护作用。此疫苗暂时只在老鼠身上进行实验,预计最快于5年后进行人体测试。[58]
2014年3月,著名华裔艾滋病研究专家何大一,在最新一期《科学》杂志刊登的研究指出,其医学团队研发一种新的注射药物,在猕猴身上注射后,猕猴3个月内不受艾滋病毒入侵,为治疗艾滋病带来新的突破。新药有助减低高危人士感染艾滋病的机会,并指出未研发艾滋病疫苗前,注射新药物的方案可用于“中间的过渡期”。他又指药物需要每季注射一次才能保持效用,但目前仍未在人体身上进行试验,他们将与药厂在美国展开临床试验,预计2015年获得新药的安全数据,并计划于高危人士中展开类似临床研究。[59]
2013年4月,距离根治艾滋病迈进一大步,丹麦研究人员使用抗癌特效药物“帕比司他”(Panobinostat),将艾滋病毒逼出脱氧核糖核酸(DNA)细胞表面,人体免疫系统之后和特制疫苗联手合作,把艾滋病毒彻底消灭。现进行人体测试,若研发成功,艾滋病或因此正式从绝症名单中剔除。[60]
一些组织(特别在非洲)拒绝相信艾滋病的存在,认为它是西方国家用来削弱发展中国家的图谋。这种对艾滋病本性的否认已经使得艾滋病危机复杂化,因为它拒绝对此进行讨论及采取预防措施。直到目前,这种观点在南非非洲人国民大会(简称非国大)中仍然很明显。但有迹象表明非洲人国民大会已开始承认艾滋病。
少数科学家继续质疑HIV和艾滋病之间的关系,或HIV的存在。诺贝尔奖得主,聚合酶链反应(polymerase chain reaction,一项重要的生物进展)的发明者,被誉为具有“近乎狂人创造者”的凯利·穆利斯,声明HIV并不引起艾滋病[61]。有一些组织,例如包括了上百的“艾滋病不同意见者”的“重新评估HIV和AIDS理论科学团体(Scientific Group for Reappraising the HIV-AIDS hypothesis)”。他们通常拒绝参加艾滋病的会议。持这种意见的科学家从怀疑逆转录酶或艾滋病的的存在到流行学结论的测试方法,他们怀疑艾滋病作为一种独立疾病的存在以及批评常规艾滋病研究人员的方法,是为艾滋病重估运动[62]。
到2002年为止,艾滋病这种全球性的传染病没有显示出感染减慢的趋势。据估计,全球有四千万的艾滋病带原者,大约有一千三百万已经死于与艾滋病有关的疾病,主要是肺结核。如果这种趋势继续发展,估计全球艾滋病的死亡数字将达到像黑死病或西班牙流感的死亡数字。
在西方国家,由于对安全性行为的教育,艾滋病病毒的感染率开始有减慢的迹象。但是,在一些特殊人群中,感染率有再次升高的迹象。例如,在英国,诊断为艾滋病的人数从2000年到2001年上升了26%。主要涉及到公众健康工作者,伴随着非法的性工作者和毒品注射者,艾滋病将仍然是一个问题。艾滋病的死亡率也有一定程度的下降,因为有了被证明能有效的压制艾滋病毒的用于治疗艾滋病的药物(目前公认最佳的疗法为“鸡尾酒疗法”)。
在中国大陆地区,第一次发现艾滋病是在1985年6月,从一名阿根廷游客身上发现,最后这位病人在北京协和医院因并发症死亡。截止到1989年底,中国大陆已经发现艾滋病感染者172名,其中大部分是吸毒人士。当年在云南吸毒人群中发现艾滋病标志着中国艾滋病开始流行。中国政府近年来也积极对公众进行艾滋病知识的宣传教育,包括向性工作者和同性恋者间进行安全性行为的教育,但收效甚微,至2006年1月25日,中国卫生部、联合国艾滋病规划署、世界卫生组织联合公布,至2005年底中国艾滋病感染者65万人,其中发病患者约7.5万人。2007年11月29日,国务院防治艾滋病工作委员会办公室、卫生部、联合国艾滋病中国专题组联合举行《中国艾滋病防治联合评估报告(2007年)》专题新闻发布会,公布了中国2007艾滋病最新资料,截至2007年底中国现存艾滋病病毒感染者和病人约70万,全人群感染率为0.05%,其中艾滋病病人8.5万人,2007年新发艾滋病病毒感染者5万,因艾滋病死亡2万人,在5万新发感染者中,异性性传播占44.7%,同性性传播占12.2%,注射吸毒传播占42%,母婴传播占1.1%。然而世界著名的艾滋病防治工作者高耀洁和很多体制外人士认为,艾滋病在中国传播的主要途径是采血(献血)、输血等医疗途径。虽然艾滋病教育在中国已逐步展开,但社会上仍然普遍对艾滋病及其感染者认识不足且带有歧视。在中国艾滋病的高发区云南省的疾控中心(CDC)自愿艾滋病检测点(VCT)每年约有2500人次的求询者,按照该疾控中心2010年的检测数据表明:异性性行为导致感染的比例已经达到30%,同性性行为的导致感染比例已经达到45%[63]。
在台湾,1984年12月首次发现艾滋病个案,在一名外籍过境旅客验出,并在1986年2月底首次发现台湾人感染案例。1988年起规定捐血者所捐血液要经过检验确定无病毒后才可使用,1990年公布《后天免疫缺乏综合症防治条例》。为增加可能罹患HIV的人筛检的意愿,政府在一些指定医院开办“匿名筛检”。台湾籍的艾滋病感染者及病患在台湾可享受免费的医疗服务,由政府负担相关医疗费用。但2006年1月1日起,艾滋病不再列入台湾全民健康保险重大伤病范围,另由政府编列公务预算;未来可能因政府公务预算减少,影响台湾籍爱滋感染者是否能够继续享有免费医疗服务。截至2013年2月28日,台湾累计有25,415人[64] 感染艾滋病毒,其中10,034人[64]病发,造成3,834人[64]死亡。
在香港,1984年发现的首例受艾滋病病毒感染个案[65];并于1985年发现首宗艾滋病发个案[66]。截至2012年12月31日,香港卫生署的艾滋病病毒感染累积个案统计:自1984年以来,累积发现5,783人[67] 受艾滋病病毒感染。自1985年以来,累积发现1,353宗[67] 艾滋病个案。在2011年第一季,肺囊虫肺炎(Pneumocystis pneumonia)是最常见的艾滋病并发症。在香港,多年来性行为都是艾滋病感染的主要途径。截至2008年9月统计,自1984年首宗病毒感染个案起,经由性接触感染的艾滋病病毒感染案例占74%;由性接触感染的艾滋病患者占85%。香港的艾滋病活动由政府和多个志愿组织主理。政府主要负责艾滋病感染的监控和政策的制定,并与其他非政府机构一同为社区提供预防或治疗教育和推广工作。
澳门卫生局自1986年首次发现外地输入的艾滋病毒感染个案,截至2012年12月31日,总计有508人[68] 感染艾滋病毒,当中73人[68] 已艾滋病发。45%[68] 染病者为从事娱乐行业的外籍人。性接触是主要的传播途径(66%)[68],当中以异性性接触感染最多(56%),同性性接触感染占9%;静脉注射吸毒的感染率占感染个案的14%[68];其余则为母婴传播、输血感染及不详[68]。
在第三世界国家,经济状况以及缺乏性教育都得感染率维持在很高的比例。一些非洲国家有高达25%的成人劳动力人口是HIV病毒携带者。当这些人口表现出艾滋病的病症时,他们将失去工作的能力,同时需要医疗保护。这很可能引起本地区社会和国家的衰退,进一步增加了他们必须面对的困难。这个地区的很多政府多年来一直否认这个问题的存在,直到现在才开始对这种情况进行工作。缺乏医疗保护,对疾病及其起因的无知,以及教育和治疗的资金问题是第三世界艾滋病病人死亡的主要原因。
| 地区 |
HIV病毒携带者或艾滋病患者总数(万) |
新增感染者(万) | 2003年死亡人数(万) |
| 非洲(撒哈拉以南) | 2,500-2,820 | 300—340 | 220—240 |
| 北非和中东 | 47-73 | 4.3—6.7 | 3.5—5 |
| 亚洲(南亚和东南亚) | 460-820 | 61—110 | 33—59 |
| 东亚和太平洋地区 | 70-130 | 15—27 | 3.2—5.8 |
| 拉丁美洲 | 130-190 | 12—18 | 4.9—7 |
| 加勒比 | 35-59 | 4.5—8 | 3—5 |
| 东欧和中亚 | 120-180 | 18—28 | 2.3—3.7 |
| 西欧 | 52-68 | 3—4 | 0.26—0.34 |
| 北美 | 79-120 | 3.6—5.4 | 1.2—1.8 |
| 澳大利亚和新西兰 | 1.2-1.8 | 0.07—0.1 | <0.01 |
| 合计 | 3,400-4,600 | 420—580 | 250—350 |
标签:style http color io os ar 使用 for strong
原文地址:http://www.cnblogs.com/biopy/p/4049759.html