标签:
最近的研究表明,哺乳动物,包括人类,main-覃一些能力在整个产后life1,2续订心肌细胞。然而,很少有或没有显著心肌损伤后regenera-灰如急性心肌infarction3。通过相比之下,斑马鱼高效再生丢失的心肌,提供了一个模型,如何理解自然心脏regenera-化可能被堵塞或enhanced4,5。在不存在适用于成年斑马鱼谱系追踪技术,新的再生心肌的细胞起源仍然不清楚。使用新的遗传命运映射方法,在这里我们确定切除心室心尖部后成为激活和突出的心脏肌肉再生促进心肌细胞的人口。通过使用转基因报告菌株的,我们发现,心肌细胞在整个一周创伤内embry- ONIC心脏发生基因GATA4的外膜心室层触发表达,前表达定位于周围增殖心肌细胞和损伤部位内。 Cre重组酶为基础的谱系追踪细胞表达GATA4明显的再生之前,或细胞表达的基因的收缩cmlc2受伤之前,在随后的再生各打成大部分心肌。通过在整个心室表面心肌的光学电压映射,我们发现,用导电重新建立现有的和再生的心肌细胞之间2和4周后的损伤之间。伤后和长时间的成纤维细胞生长因子受体抑制逮捕心脏再生,使疤痕地层,实验释放的信号块导致GATA4表达和受伤vent- ricular墙形态的改善,无瘢痕组织的损失。我们的研究结果表明,电耦合心肌切除损伤后再生,主要是通过激活和扩增cardiomyo- CYTE种群。这些发现对于促进受伤人的心脏再生的影响。
去除他们的心脏心室的顶点后,斑马鱼取代切除myocardium4,5。虽然这些事件涉及心血管肌细胞增生,目前还不清楚增殖cardiomyo-核细胞是否从现有肌细胞或来自非心肌细胞的来源,如干细胞衍生。确定胚胎或再生器官细胞的贡献也通常涉及遗传方式不可逆标记不同的细胞类型,并跟踪他们的progeny6-11。
虽然寻找分子标记信息的再生,我们确定了GATA4的上游法规保守党序列驱动的独特的表达方式,一种转录因子基因在发展中胚胎心脏表达和正常心脏的图案部分ING和vascularization12-17至关重要。通过使用的Tg(GATA4:EGFP)的AE1记者line18,我们发现绿色荧光蛋白(EGFP)的荧光在未受伤的成年心室基本上不存在。然而,切除心室心尖部后,GATA4驱动EGFP转期间从3至7天后截肢诱导细胞的整个心室心肌的外致密层的高百分比(DPA)(图1a,D, F,G)。 GATA4:EGFP表达于周围的许多细胞和损伤部位由2周损伤(图1H)后的,并在所有的时间点被限制在细胞阳性肌细胞标志物(图1b中,c)和阴性的标记物心外膜,一个vas- culogenic间皮层覆盖在紧凑肌肉(图1e)。尿嘧啶(5-溴脱氧尿苷)-labelling的研究表明,许多GATA4:EGFP1细胞在伤口处7 DPA,并在伤口处14 DPA内,最近发生了DNA的合成(图1J,K)的侧边缘。 30政治部,再生室壁的大部分面积仍标记的GATA4:EGFP荧光(图1I)。在这些阶段,GATA4:EGFP表达主要标记的紧凑cardiomyo-核细胞,其通常占据再生比内小梁cardiomyocytes4的较大部分。荧光vent- ricular肌肉再生,在组织学的不同阶段,定量表示GATA4驱动EGFP的表达,从伤口边缘渐进引入到损伤部位(补充图2A,B)。
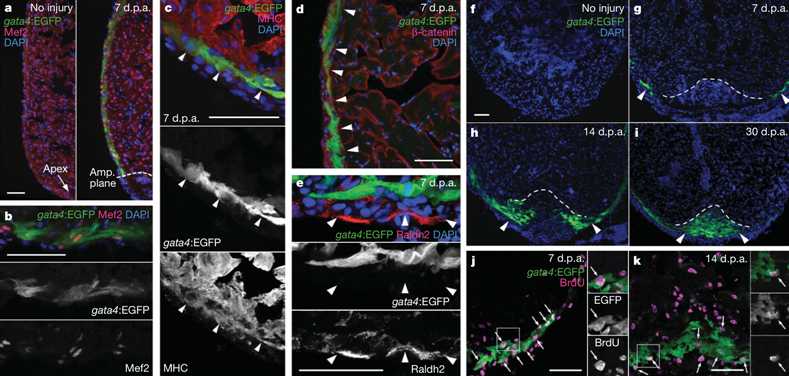
图1 |心肌标志GATA4:EGFP受损伤激活,增殖,在损伤部位。一,GATA4:EGFP诱导细胞各地在紧凑型肌7 DPA (右)。放大器。截肢。 B,C,GATA4:EGFP(在C箭头)共同标签与心肌标志物MEF2(b)和肌球蛋白重链(MHC)(C)。 DAPI,49,6二脒基-2-苯基吲哚。D,GATA4:EGFP(箭头)共同染色用b-catenin的,这说明心肌壁内EGFP限制。 E,GATA4:EGFP不共定位一个3×车辆,14 d.p.a.DAPI EGFPB 3×车辆,30 d.p.a.与心外膜RALDH2蛋白质(箭头)。 F-Ⅰ,GATA4:EGFP表达(箭头)在未受伤和再生心室。虚线表示切除近似平面。 J,K,BrdU标记和7(j)和14免疫荧光法(k)的DPA GATA4:EGFP心室。箭头指示共同的标签。单焦片显示在B-e和插图中j和k。的7-或8-毫米的Z堆叠共焦突起示于j和k。比例尺50毫米。
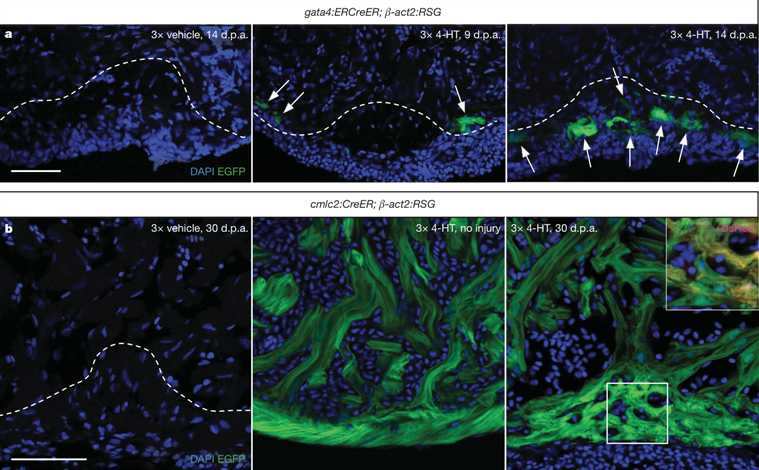
图2| gata41心肌细胞对心脏再生的重大贡献。一,GATA4:ERCreER; B-ACT2:RSG动物在9(中心; N5)注射每天一次媒介物(左)或4-羟色胺在5-7 DPA,收集前或14(右; N5 6)DPA EGFP荧光(箭头)在受伤边界9 DPA观察和损伤部位14 d.p.a.内虚线表示
切除近似平面。 B,cmlc2:瑰珀翠; B-ACT2:RSG动物用车辆(左)或4-HT受伤之前注射每天一次持续3天。 4-HT的未受伤的心室(中心)和30 DPA标记心肌绝大多数回收物(权; N510)。插图,红色荧光蛋白通道用于标记效率的计算。显示单共聚焦切片。比例尺50毫米。
澄清这些事件的动力学,我们产生了新的转基因品系,以促进诱导的,Cre重组酶为基础的谱系从gata41细胞跟踪。我们创建了一个带有tamoxifen-诱导Cre重组雌激素受体融合由GATA4调节序列,TG(GATA4:ERCreER)驱动蛋白的线pd39,以及一个指示线切除后,将允许的心肌细胞的EGFP荧光可视loxP的侧翼停止序列,TG(bactin2:loxP的红色荧光蛋白-STOP-loxP的EGFP)S928(B-ACT2:RSG;补充性图3)。我们每天注射一次,4-羟基(4-HT)或车辆进入GATA4:ERCreER; B-ACT2:5-7 DPA,在损伤部位检测GATA4驱动的EGFP荧光之前的时间点RSG动物。注射GATA4的:ERCreER; B-ACT2:RSG动物4-HT,但不是汽车,打成什么想必代表肌细胞,在GATA4发出荧光的一个子集:EGFP线,露出一小部分EGFP1心肌接壤伤口9 DPA此外,EGFP1心肌连续的区域可在损伤部位14 DPA检测(图2a),代表在20d.pa在标有心肌一quanti- fiably显著扩张(补充图2a,C)。这些结果表明了一种机制,其中心外膜细胞在整个心室损伤响应通过诱导GATA4的表达,与细胞邻近损伤部位prolif-展业务并促进新的心肌细胞的比例很高。
虽然共焦成像共定位GATA4驱动EGFP和肌标记,它仍然可能非肌细胞诱导GATA4损伤后迅速分化为增殖CAR- diomyocytes。为了测试在何种程度上现有的心肌细胞向再生,我们创造了一个菌株,其中tamoxifen-诱导Cre的由收缩基因心肌肌球蛋白轻链2(cmlc2,也称为MYL7)的Tg(cmlc2的调控序列驱动:瑰珀翠)PD10。贴标效率的测量表明,我们的4-HT注射协议标记,95%未受伤cmlc2的:瑰珀翠; B-ACT2:RSG心室肌细胞与EGFP荧光(补充图4)。上的几个不同的指示线分析的基础上,通过cmlc2驱动瑰珀翠标记是特异于心肌细胞(补充图5),并且没有被保护研究机构由损伤或车辆注入门控(图2b)。标签心肌五天后,我们切除心室顶点,并允许再生30天。我们发现在EGFP1心肌再生cmlc2的比例没有显著差异:瑰珀翠; B-ACT2:RSG组织相比,注射后5或35天收集未受伤的心室,结果表明新cardiomyo-核细胞绝大多数来自细胞表达伤(图2b和补充图4)前cmlc2派生。
成功再生的一个关键方面是新创建的细胞到现有组织的功能IN-公司。我们标记的全植心与跨膜电位敏感的染料二-4- ANEPPS,并进行表面平心肌包括所述致密层和再生的光学电压映射。在7 DPA,和不太所以在14 DPA,有靠近心室的心尖的等时线的增加的密度相比于未受伤的对照,表明传导的显着减慢(图3a)。此外,电活动始终未能传播到再生顶点7 DPA,而冲动再次在整个脑室14 DPA进行当大量新gata41心肌细胞出现(图3a)。 30 DPA,等时线的密度在顶点出现正常(图3a)。这些观察结果直接估计传导速度,这揭示了远端心室传导在7和14 DPA放缓,而正常传导,在30 DPA证实(图3b)。我们还发现,在7 DPA,它完全是由14 DPA恢复一个显著减少的最大速率去极化证据,而动作潜在持续时间是在各组(图3c和补充图6)是相同的。因此,我们的成像数据表明,新的心尖心肌的电耦合开始发生由,2周后损伤,具有完全耦合在恢复的壁30 DPA
斑马鱼的心脏损伤正常再生反应被认为是阻止或超出竞争次要疤痕response4。为了测试再生疤痕后可出现是否建立,我们受伤的Tg(HSP70:DN-FGFR1)PD1脑室和诱导表达显性负成纤维细胞生长因子(FGF)通过热休克受体30天,造成再生逮捕和scarring19(图4a,b)中。然后,我们启用FGF信号通过去除耐热冲击为14天或60天。有趣的是,还原的FGF的14天信令中的73%的伤口增加心肌,与热休克蛋白70(补充性图7):DN-FGFR1; GATA4:含GATA4领域EGFP顶点:EGFP1心肌(图4C,D)。当我们恢复FGF信号到疤痕心为60天的延长期间,纤维蛋白从伤口清零,尽管我们没有观察到的瘢痕组织的损失。值得注意的是,90%的损伤部位的显示组织学改善FGF信号的扩展后复原,包括已经形成肌肉的连续壁包封瘢痕(图4e-h)中的60%。这些结果表明,再生信号被保持在斑马鱼心中既定损伤疤痕,其在哺乳动物中提出了一个障碍心肌infarction20,21的基于细胞的疗法的环境。因此,背后斑马鱼心脏再生的机制可能是相关心肌梗死的人的幸存者拥有成熟的疤痕组织和受损ventricu- LAR墙壁。
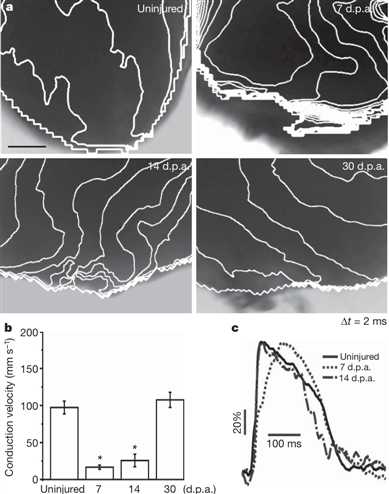
图3 |再生心肌细胞的电耦合。一,表面心肌邻近的未受损伤的,7,14和30 DPA植的顶点两毫秒等时密度图心室。比例尺100毫米。
B,平均从局部速度矢量测量的传导速度,表明在7和14 DPA速度放缓平均6 SEM中,n5月4日至7日的脑室每个时间点。 * P,0.05(单向方差分析(ANOVA))。 C,表面动作电位代表的痕迹,表示最大去极化率在7 DPA放缓。
早期的研究评估为快(EGFP)和慢(核的DsRed2)的双转基因的Tg(cmlc2:EGFP)折叠记者f1或twu26; TG(cmlc2:nucDsRed2)F2斑马鱼来记录证据新鲜成熟cmlc22祖细胞的增殖成cardiomyo-核细胞。具体地讲,许多EGFP1 nucDsRed22心肌细胞中观察到的显影胚胎心脏和再生成人ventricle19,22。我们重新研究了子stituting cmlc2的细胞质的DsRed2记者,去除细胞核定位可能会减少在动态发展性事件的灵敏度记者的元素这一发展时序分析(TG(cmlc2:的DsRed2)PD15)。我们观察EGFP1 DsRed22肌细胞中的胚胎,但不是在7 DPA成人重新生成,其代替含有EGFP1 DsRed21肌细胞与每个胞质记者荧光在较低的强度比在非再生肌肉(补充图8)。加上cmlc2:瑰珀翠世系追踪数据,这些新的结果主张修改以前的解读,并表示参与心肌再生拥有或获得一个不成熟的表型,降低cmlc2表达。这种表型是由心肌细胞在14 DPA超微结构特征可能反映再生,我们没有在文氏未受伤的心外膜下tricles心肌细胞,包括减少肌结构,异形线粒dria,低线粒体密度(补充图9)观察。
总之,我们已经确定了zeb- rafish心脏再生有密切关系的起源,功能和心肌再生的容错能力的新机械方面。最重要的,我们发现心肌细胞的室壁爱科特内的亚群vates GATA4调节序列,增殖,并促进子stantially局部肌肉再生。到其他细胞群可能提供再生的程度有待进一步直接线性EAGE跟踪实验。值得注意的是,GATA4的活化:EGFP表达在外膜心肌平行于覆心外膜细胞迅速,腔宽损伤反应之前,他们也纳入再生area19。这些muscularizing和血管化tis-的起诉的类似Spa - 配tiotemporal动态显示重要的互动,因为他们每个被激活,增殖,并整合到损伤部位。
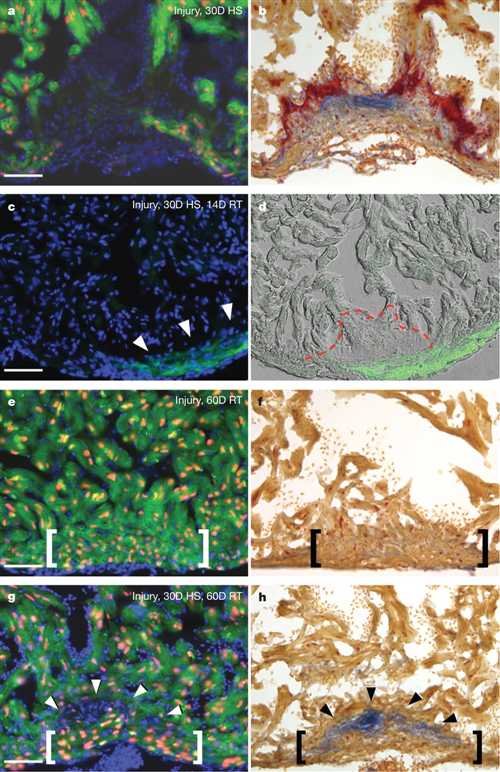
图4|恢复GATA4的:EGFP表达和一个新的室壁疤痕后。 A,B,典型的伤口切除后30天(D)FGF受体(FGFR)抑制。 HS,热休克。 C,D,GATA4:诱导损伤30天FGFR抑制,和14天的恢复在室温下的一个方案的EGFP荧光(箭头)(RT; N58)。虚线表示的伤口。 E,F,正常再生(括号内)后,受伤和室温孵育60天。G,H,60天室温恢复,切除30天FGFR抑制后,提高了壁解剖学(括号中)不除去瘢痕(箭头; N510)。绿色,EGFP-标记Dnfgfr1;通过cmlc2红色,肌细胞的细胞核:nucDsRed2在转基因
A,E和g。酸性品红橙黄G染色(红,血纤蛋白;蓝色,胶原)的B,F和h。动物热休克心脏采集前4小时,在E和G,诱导EGFP。比例尺50毫米。
我们的研究结果耐人寻味鉴于描述的因素最近有报道称推出可以增加differen- tiated心肌细胞的增殖和改善功能的受伤成年哺乳动物heart23-26时。它是可能的斑马鱼心脏提供鼓励活化和/或心肌细胞的亚群的增殖的优化损伤的环境。在斑马鱼的Cre为基础的工具,包括那些我们在这里描述的,可以使精确实验操作基因表达或功能的尝试来修改损伤环境或再生反应。随着新的心肌细胞的关键来源的知识,即介导心脏regenera-灰在斑马鱼的细胞和分子的相互作用的监管,现在可以更informatively追求的。
远交Ekkwill株(EK)或EK / AB混合背景斑马鱼6-12个月的婴儿被??用于心室切除手术所描述previously4。所有的转基因品系进行了分析半合子;它们的结构的细节,在方法中描述。动物密度维持在4鱼L21在所有实验中。 4-羟基(4-HT)(Sigma公司)溶于乙醇(5mgml21)在水中稀释至0.5mgml21为腹膜内注射。百分之十的乙醇被用作载体对照。 EGFP标记的定量是在方法中描述。热休克实验进行描述previously27,使用双转基因HSP70:dnfgfr1; cmlc2:nucDsRed2或HSP70:dnfgfr1; GATA4:EGFP动物。对于BrdU的掺入实验,2.5毫克ML21尿嘧啶(Sigma公司)腹腔注射,每天一次收集前3天。免疫荧光法,原位杂交,和酸性品红橙黄G污渍(检测的血纤维蛋白和胶原蛋白)进行描述previously4。在这项研究中使用的一抗是:抗MEF2(兔; Santa Cruz Biotechnology公司),抗肌球蛋白重链(F59,小鼠;发育研究杂交瘤库),抗β-联蛋白(兔; Sigma公司),抗ZF RALDH2 (兔:Abmart),抗-BrdU(大鼠;准确),和抗GFP(兔,仅用于共检测用BrdU使用; Invitrogen)中。在这项研究中使用的二抗(Invitrogen)中分别将Alexa Fluor 594山羊抗兔IgG(H1L)抗MEF2,将Alexa Fluor 594山羊抗 - 小鼠IgG(H1L)对于F59,将Alexa Fluor 594山羊抗大鼠IgG(H1L )对于抗BrdU,和Alexa Fluor 488山羊抗兔IgG(H1L),用于抗GFP。原位杂交和免疫荧光图像使用Leica DM6000显微镜用Retiga-EXI相机(C-IMAGING)拍摄,并使用Leica SP2或SP5共焦显微镜共焦图像拍摄。生理方法在方法中描述。
全部方法和任何相关引用的文件在www.nature.com/nature在线版本。
1.贝格曼,O。等人。在人类心肌细胞更新的证据。科学324,98-102(2009年)。
2. Quaini,F。等。嵌合体移植心脏的。 N.英格兰。 J.医学。 346,5-15(2002)。
3.鲁巴特,M&领域,LJ心脏再生:重新填充的心脏。际货。启示录
生理学。 68,29-49(2006)。
4. POSS,KD,威尔逊,LG和基廷,MT心脏再生的斑马鱼。科学
298,2188年至2190年(2002年)。
5.芝,A。等。 Notch信号通路的激活之前心脏再生
在斑马鱼。 PROC。国家科学院院报。科幻。美国100,11889-11895(2003)。
6.蔡C. L.等。 Isl1标识的前一个遍布心脏祖人口
分化并促进大多数细胞对心脏。开发。电池5,
877-889(2003)。
7.多尔,Y.,布朗,J.,马丁内斯,OI&麦尔登,DA成人胰腺β细胞
通过自我复制,而不是干细胞的分化而形成的。自然429,
41-46(2004)。
8.谢,P. C.等。从遗传的命运映射研究,干细胞的证据
伤后刷新成年哺乳动物的心肌细胞。自然医学。 13,970-974
(2007)。
9. Laugwitz,K。L.等人。产后isl11 cardioblasts进入完全分化
心肌细胞谱系。自然433,647-653(2005)。
10.梅亚克,S.M。等人。心肌回顾性克隆分析揭示2
在发育中的小鼠心脏克隆生长的阶段。开发130,
3877-3889(2003)。
11周,B。等。心外膜祖细胞有助于在心肌细胞谱系
发育的心脏。自然454,109-113(2008)。
12. Holtzinger表示,A&埃文斯T. GATA4调节多个器官的形成。
显影器132,4005-4014(2005)。
13. CRISPINO,J.D。等人。适当的冠状动脉血管发育和心脏
形态取决于GATA-4与FOG辅助因子的相互作用。基因开发。 15,839-844(2001)。
14. Molkentin,JD,林,Q.,邓肯,SA和奥尔森,转录因子GATA4对心脏血管形成和腹部形态的EN要求。基因开发。 11,1061至1072年(1997年)。
15.郭,C·T等。 GATA4转录因子所需的腹侧形态和心脏血管形成。基因开发。 11,1048至1060年(1997年)。
16. Zeisberg,E.M。等人。右心室的形态,需要GATA4心肌表达。 J.临床。投资。 115,1522年至1531年(2005年)。
17.浦,WT,石绵,T.,Juraszek,AL,马,问:&出云,S. GATA4是心脏形态的dosage-敏感的调节器。开发。生物学。 275,235-244(2004)。 18. Heicklen - 克莱恩,A.&埃文斯T. T-box结合位点都需要一个活动
心脏转录因子GATA-4增强剂。开发。生物学。 267,490-504(2004)。
19. Lepilina,A。等。一个充满活力的心外膜损伤反应支持祖细胞
在斑马鱼心脏再生活动。细胞127,607-619(2006)。
20. Laflamme编写,MA,ZBINDEN,S.,爱泼斯坦,SE和默里,CECell-basedtherapyfor心肌缺血和梗死的病理生理机制。际货。启示录
病理学。 2,307-339(2007)。
21. Passier,R.,面包车Laake,LW&马默里,CL干细胞为基础的治疗和
从心脏的教训。自然453,322-329(2008)。
22. dePater,E.etal.Distinctphasesofcardiomyocytedifferentiationregulategrowth
的斑马鱼心脏。发展136,1633年至1641年(2009年)。
23. Bersell,K.,阿拉伯,S.,哈林,B.&库恩B. Neuregulin1 / ERBB4信号诱导
心肌细胞增殖和修复心脏损伤。单元138,257-270(2009)。 24.古HN,B.etal.Periostininducesproliferationofdifferentiatedcardiomyocytesand
促进心脏修复。自然医学。 13,962-969(2007)。
25.恩格尔,FB,谢,PC,李某,RT和基廷,MT FGF1 / P38 MAP激酶抑制剂
治疗诱导心肌细胞有丝分裂,减少了疤痕,并且抢救功能
后心肌梗死。 PROC。国家科学院院报。科幻。美国103,15546-15551(2006)。 26.恩格尔,F B。等。 p38MAP激酶抑制使成人的增殖
哺乳动物的心肌细胞。基因开发。 19,1175年至1187年(2005年)。
27.遗嘱,AA,Holdway,乙脑,主要,RJ&POSS,KDRegulatedadditionofnew
心肌和心外膜细胞培育心脏稳态增长和维护的成年斑马鱼。发展135,183-192(2008)。
补充信息链接到纸张在www.nature.com/nature在线版本。
28.松田,T。&Cepko,通过体内电穿孔引入转基因的CL受控表达。 PROC。国家科学院院报。科幻。美国104,一○二七年至1032年(2007年)。
29.尔姆,V.etal.I-sceimeganucleasemediateshighlyefficienttransgenesisin鱼。机甲。开发。 118,91-98(2002)。
30.因陀罗,AKetal.Temporally-controlledsite-specificmutagenesisinthebasal layeroftheepidermis:comparisonoftherecombinaseactivityofthetamoxifen-诱导酶Cre-ER(T)和酶Cre-尔(T2)重组酶。核酸研究。 27,4324-4327(1999)。
31. Rottbauer,W。等人。 Reptin和桥蛋白拮抗调节心脏生长在斑马鱼胚胎。细胞111,661-672(2002)。
32.韦克斯曼,JS,基冈,BR,罗伯茨,RW,POSS,KD及Yelon,D.Hoxb5bacts downstreamofretinoicacidsignalingintheforelimbfieldtorestrictheartfield在斑马鱼的潜力。开发。电池15,923-934(2008)。
33.西多罗夫,VY,霍尔库姆,MR,伍兹,MC,灰色,RA和Wikswo,在离体兔heart.BasicRes.Cardiol.103,537-551(2008年)的电压和钙分布JPEffectsof单极刺激。
34.布雷特,F.etal.Characterizationofisolatedventricularmyocytesfromadult斑马鱼(斑马鱼)。生化。生物物理。水库。 COMMUN。 374,143-146(2008)。
35.快速,VG和克莱伯,AGCardiactissuegeometryasadeterminantof单向传导阻滞:微观激励光学映射图案的细胞培养,并在计算机模型中传播的评估。心脏除颤。 Res.29,697-707(1995年)。
36.贝利,PVetal.Estimationofconductionvelocityvectorfieldsfromepicardial地图数据。 IEEE跨。生物医学。工程。 45,563-571(1998)。
致谢感谢J.伯里斯和A. Eastes斑马鱼护理,X.萌和发展研究杂交瘤细胞银行抗体,M.吉尼亚克的帮助,电子显微镜,实验室成员对稿件的意见,和G.伯恩斯P.尚邦和G. Felsenfeld的质粒。这项工作是由美国心脏协会(KK和YF),JDRF(RMA)和JSP(KK)支持博士后奖学金; NIH培训补助HL007208在美国马萨诸塞州总医院(AAW)和HL007101在杜克大学医学中心(GFE);从NHLBI(HL064282到TE,HL054737到DYRS,并HL081674到KDP),NIGMS(GM075846到CAM),三月角钱(CAM)补助金;从AHA,皮尤慈善信托基金和怀特海基金会(KDP)资助。
作者投稿株和K.D.P.设计实验策略,分析数据,并准备手稿。株式会社J.E.H.和Y.F.生成并表征为谱系追踪转基因品系。 R.M.A.和D.Y.R.S.提供未公开的试剂谱系追踪。株式会社J.E.H.和K.D.P.进行再生实验。 J.E.H.进行电子显微镜。 A.A.W.,G.F.E.和C.A.M.设计生理学实验和解释数据。 A.A.W.进行光学测绘实验。 T.E.帮助设计战略,并提供关键试剂。所有作者评论稿件。
作者信息重印和权限的信息,请访问www.nature.com/reprints。作者宣称没有竞争的财务权益。信件和要求的材料应该给KDP (k.poss@cellbio.duke.edu)。
施工GATA4的:ERCreER转基因动物。 ERT2-的Cre-ERT2互补的pCAG-ERT2CreERT2 DNA(参见28)克隆的14.8千碱基(KB)GATA4 promoter18的下游。整个结构是用两侧采用大范围核酸酶method29 I-SceI的网站进行转基因。这种转基因行的全称是的Tg(GATA4:ERCreER)pd39。
施工cmlc2的:瑰珀翠转基因动物。 CRE-ERT2 cDNA的pCre- ERT2(参见30)克隆了5.1 kb的cmlc2 promoter31的下游。甲DsRed-实施例磁带盒由透镜特异性晶状控制,α-启动子也包括在内(cryaa:红色荧光蛋白),使由透镜fluorescence32视觉识别转基因动物,并于上游亚克隆的cmlc2的:瑰珀翠序列以相反的方向。整个构建体侧翼与鸡b-珠蛋白绝缘体(23芯绝缘子元件)(由G. Felsenfeld提供)的核心元件的两个副本,然后与I-SceI位点侧接。这种转基因行的全称是的Tg(cmlc2:瑰珀翠)PD10。
建设B-ACT2的:RSG转基因动物。我们亚克隆9.8 kb的基因型的话筒DNA导入改性PBSK矢量紧接bactin2转录起始位点的上游多克隆位点由Ⅰ-SceⅠ限制性酶切位点侧接。一个loxP的红色荧光蛋白-STOP-loxP的EGFP盒亚克隆的bactin2子下游。的红色荧光蛋白-STOP盒用作标记的转基因,并且还防止EGFP蛋白的通读翻译。这个构建体注射到使用标准的大范围核酸酶转基因techniques29单细胞阶段的野生型胚胎。一创始人分离并从注射的胚胎propa-门控。这种转基因行的全称是的Tg(bactin2:loxP的红色荧光蛋白-STOP-loxP的EGFP)S928。
建设5-kb的B-ACT2:RNG和HSP70:RNG的转基因动物。该pBigT载体用于使含有两侧装接loxP mCherry盒与转录终止一个盒,一个EGFP盒的上游具有标记的核定位信号三份(33 NLS-EGFP)的第二loxP序列的下游。所得盒(loxP的mCherry-STOP-loxP的nucEGFP)溶液,然后亚克隆下游,10-kb的斑马鱼bactin2启动子,或一个,1.5-kb的斑马鱼的hsp70启动子的一个,5.3-kb的片段。所述构建体侧翼的两个副本鸡球蛋白绝缘子(23芯绝缘子元件)(由G. Felsenfeld提供)的核心元件,以及两个I-SceI位位点。转基因株系的全名是的Tg(bactin2:loxP的mCherry-STOP-loxP- nucEGFP)PD31和TG(hsp70l:loxP的mCherry-STOP-loxP的nucEGFP)PD30。施工GATA5的:RNG转基因动物。 GATA5在BAC克隆DKEYP-73A2的转译起始密码子被替换为loxP的mCherry- STOP-loxP的nucEGFP(RNG)由Red / ET重组工程技术(GeneBridges)盒。在59和39同源臂对于重组是一个716个碱基对(bp)片段的起始密码子的上游,而一个517-bp片段的下游,分别和亚克隆到侧翼的RNG盒。为了避免该RNG盒和内源loxP序列的BAC载体之间的潜在失重组,我们替换载体衍生的loxP序列与使用相同技术的I-SceI位点。最终的BAC进行精制nucleobond BAC 100试剂盒(Clontech公司),和共注射与大范围核酸酶成单细胞阶段zebra-鱼胚胎。这种转基因行的全称是的Tg(GATA5:loxP的mCherry- STOP-loxP的nucEGFP)PD40。
施工cmlc2的:的DsRed2转基因动物。的DsRed2 cDNA克隆的5.1-kb的cmlc2启动子的后面,而整个盒侧翼与I-SceI位位点。这种转基因行的全称是的Tg(cmlc2:的DsRed2)PD15。
4-HT标签和EGFP荧光cmlc2量化:瑰珀翠; B-ACT2:RSG动物。为了确定4-HT标签动力学,我们给单次20毫升低剂量的4-HT来未受伤cmlc2(2.5毫克ML21)腹腔注射:瑰珀翠; B-ACT2:RSG成人。我们发现重组由肌细胞的EGFP荧光在心室部分在1天注射后(dpi)的,并且在增加的频率(,心室肌细胞的20%)和强度由2 dpi的在注射后3,4和5天检查的心室部分表示EGFP标签的频率相似2 dpi的这些发现提供的证据表明,腹腔注射4-HT不再能后2 dpi的刺激成年斑马鱼心室心肌新recom- bination事件。
为了量化EGFP表达的谱系追踪与cmlc2实验Cre重组酶介导的释放:瑰珀翠; B-ACT2:RSG动物,三段包括再生每个心脏被选中。对于未受伤的控制心中,最大的三个部分分别从每个心脏描述previously27选择。我们使用DsRed1区域,以反映总心肌部分的表面积,为之后4-HT注射在B-ACT2红色荧光蛋白的表达背景坚持心肌:RSG转基因鱼。这可能是由于多种转基因拷贝,允许逸出一些两侧装接loxP从CRE介导recombina-灰(补充图2)红色荧光蛋白盒。心室心尖部单光片图像调节增益,以检测高于本底水平EGFP或红色荧光蛋白信号均于340??(1024 3 1024像素)。在受伤的顶点的区域(504 3 504像素)被选择以包括大部分的图像中的再生,并
裁剪使用Photoshop软件。相同的区域被裁剪的vent- ricular顶点为未受伤的动物。 EGFP1和DsRed1区域进行定量在通过的ImageJ软件像素,并计算EGFP1的相对DsRed1区域的百分比。
EGFP和GATA4:EGFP荧光GATA4量化ERCreER; B-ACT2:RSG动物。为了量化EGFP1区,3个部分,包括伤口/再生从每个心脏选中。心室心尖的??图像使用Leica DM6000显微镜用Retiga-EXI相机(C-IMAGING)取在320。一个区域(109 3 109像素GATA4:EGFP动物和73 3 73像素GATA4:ERCreER; B-ACT2:RSG动物)被指定在每个侧切伤口边缘和剪裁用Photoshop软件(见补充图2。动画片)。一个区域(109 3 218像素GATA4:EGFP动物和73 3 146像素GATA4:ERCreER; B-ACT2:RSG动物)与横向的区域不重叠的被指定并裁剪在损伤部位。 EGFP1区域进行定量在通过的ImageJ软件像素,并总结出的像素的数目并取平均值,得到的边缘EGFP1面积和损伤部位EGFP1面积为每个心脏。
透射电子显微镜。受伤的心被固定在2.5%的谷氨酸raldehyde,在0.1M的二甲胂酸钠缓冲液2%的甲醛。组织进行后固定在1%的OsO 4,脱水,包埋在斯珀尔的树脂(EMS),以及切片使用ULTRACUT或ULTRACUT E超薄切片机(Leica公司)70-90纳米厚度。所述切片用乙酸双氧铀和柠檬酸铅。显微镜在FEI TECNAI G2双透射电子显微镜进行,图像使用滨松ORCA-HR的数码相机和AMT软件获得。光映射。鱼麻醉用0.1%的3-氨基苯甲酸甲酯,和心脏中分离出30秒内,并置于含有的Tyrode溶液(以mM计)Na1而(136),K 1(5.4),MG21(1.0),PO432(0.3), CA21(1.8),葡萄糖(5.0)和HEPES(10.0),在pH 7.4。心加载10分钟,用跨膜电位 - 敏感性染料二-4- ANEPPS(D-1199,Invitrogen)中,将其溶解于Tyrode溶液中。染色后,将制备物转移到录音室(华纳仪器),其中载补充有兴奋收缩分离器II型肌球蛋白的30毫米(EMD化学公司)中的光测量值,以抑制收缩的Tyrode溶液中。该室被安装在倒置显微镜(TE-2000U,尼康)配备有高速CCD照相机(CCD-心SMQ,红衫成像)用80 3 80像素帧的阶段。使用就位用微型机器人心脏的基地附近的罚款铂电极的心就点 - 刺激60次每分钟。该电极位置消除了假象增加传导速度由于多个像素邻近的刺激部位的同时本地捕获(即,虚拟电极效果)33。光学动作电位录从顶点的心外膜表面。荧光很兴奋有120瓦的金属卤化物弧灯(X-举122,EXFO)和过滤,在540 6 25纳米。荧光发射被聚焦到相机之前通过长通发射滤光片(585 nm)的通过。光学倍率为32致使记录像素之间11毫米的空间分辨率。照相机在2000帧每秒操作和信号进行数字化,以14位的精度。信号进行数字化,在时间(900赫截止),过滤和空间(4像素的加权平均)结构域,以降低噪音。记录与该系统的动作电位所描绘的膜电位变化的时间过程与保真度相媲美记录有膜片钳technique34动作电位。
光学标测荧光数据分析。使用专为从斑马鱼心脏(MATLAB,Mathworks公司)录得光学动作电位分析编写定制软件获得的荧光数据进行了分析。动作电位持续时间(APD)被定义为20%的去极化和80%的收益率或复极之间的时间间隔,以静息电位(APD80)。动作电位上升速率是来自动作电位的第一时间导数的最大值。激活时间被定义为50%的去极化的过程中的动作电位的上升阶段的时间。我们已经使用局部活动的这一标准,因为时间在一半最大值处的去极化已在计算机模拟先前表明密切到最大蜂窝钠influx35对应。中显示的波前以恒定的时间间隔(2毫秒)的位置等时的地图是从使用轮廓绘制由Matlab软件提供的功能的激活此灰倍构成。传导速度矢量场被利用已建立的上述算法previously36的激活时间估计。简言之,局部速度矢量,它代表传播去极化波在每个记录点的大小和方向,分别计算由嵌合在每个站点测量以抛物线二维表面的去极化时间。在每个站点的速度矢量的分量,计算从在该表面上的梯度的分量。传导速度跨越位于靠近每个心脏顶点(补充图10)200 3 200平方毫米的站点进行平均。
标签:
原文地址:http://www.cnblogs.com/xishuai/p/4314303.html