标签:
| 本条目需要补充更多来源。(2012年9月10日) |
| 过氧化氢 | |||
|---|---|---|---|
 |
|||
|
|
|||
| IUPAC名 Hydrogen peroxide |
|||
| 别名 | 双氧水 | ||
| 识别 | |||
| CAS号 | 7722-84-1 | ||
| RTECS | MX0900000 | ||
| 性质 | |||
| 化学式 | H2O2 | ||
| 摩尔质量 | 34.0147 g·mol?¹ | ||
| 外观 | 淡蓝色液体 溶液无色 |
||
| 密度 | 1.463 g/cm3 (液) | ||
| 熔点 | −0.43 °C(31.23 °F;272.72 K) | ||
| 沸点 | 150.2 °C(302.4 °F;423.3 K) | ||
| 溶解性(水) | 混溶 | ||
| pKa | 11.65 | ||
| 黏度 | 1.245P,当室温为20 °C(68 °F;293 K) | ||
| 偶极矩 | 2.26D | ||
| 危险性 | |||
| 警示术语 | R:R5-R8-R20-R22-R35 | ||
| 安全术语 | S:(S1/2)-S17-S26-S28-S36-S37-S39-S45 | ||
| MSDS | 30%过氧化氢—MSDS 60%过氧化氢—MSDS |
||
| 主要危害 | 氧化性、腐蚀性 | ||
| NFPA 704 | |||
| 闪点 | 不可燃 | ||
| LD50 | 1518 mg/kg | ||
| 相关物质 | |||
| 相关化学品 | 水、臭氧、肼 硫氧化氢、二硫化氢、多硫化氢 |
||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
过氧化氢,分子式H2O2,是除水外的另一种氢的氧化物。粘性比水稍微高,化学性质不稳定,一般以30%或60%的水溶液形式存放,其水溶液俗称双氧水。过氧化氢有很强的氧化性,且具弱酸性。
纯过氧化氢是淡蓝色的粘稠液体,熔点−0.43 °C(31.23 °F),沸点150.2 °C(302.4 °F)。凝固点时固体密度为1.71g/cm3,密度随温度升高而减小。它的缔合程度比H2O大,所以它的介电系数和沸点比水高。纯过氧化氢比较稳定,若加热到153 °C(307 °F)便猛烈的分解为水和氧气。
过氧化氢可与水以任意比互溶,因其可以发生微弱电离,所以溶液呈弱酸性。
过氧化氢与过量氢氧化钠反应的产物是NaHO2和H2O。而与氢氧化钡反应时产物为过氧化钡。
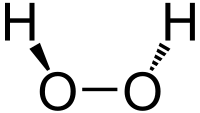
过氧化氢分子为椅型结构,见下图。左图为气态时的结构,右图为固态晶体时的结构:
过氧化氢可溶于乙醇、乙醚,不溶于苯。对有机物有很强的氧化作用,一般作为氧化剂使用。
体内的过氧化氢酶(Catalase)可以催化双氧水的分解反应,使其释放出氧气,转化为对机体无毒的水:
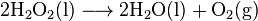
1818年,L.J.Thenard发现水系无机物、有机物在自动氧化时,或者在生物体内呼吸氧气时,在生成水之前会生成过氧化氢。
1950年代以前采用电解法制备过氧化氢——电解硫酸氢盐溶液(如硫酸氢铵、硫酸氢钾)得到过二硫酸盐[1],再加入硫酸[2]使过二硫酸水解[3]得到过氧化氢。 1953年,杜邦公司采用蒽醌法制备,以烷基蒽醌如2-乙基蒽醌为媒介物,循环氧化还原制得。现在世界各国基本上都是用这一技术。
| 氧化剂 | 氧化电位 V |
|---|---|
| 氟气 | 3.0 |
| 羟基自由基 | 2.8 |
| 臭氧 | 2.1 |
| 过氧化氢 | 1.8 |
| 高锰酸钾 | 1.7 |
| 二氧化氯 | 1.5 |
| 氯气 | 1.4 |
过氧化氢是非常强的氧化剂,它和其他氧化剂的标准电极电势值列在右面,值越高代表氧化性越强:

该反应在热力学上自发进行:ΔHo为−98.2 kJ·mol−1,ΔGo为−119.2 kJ·mol−1,ΔS为70.5 J·mol−1·K−1。重金属离子Fe2+、Mn2+、Cu2+等对过氧化氢的分解有催化作用。它们在酸性溶液中的电势介于过氧化氢的电势(0.694~1.76V)之间。例如Fe3+,认为过氧化氢把Fe3+还原为Fe2+,而本身被氧化成氧气,产生的Fe2+又被过氧化氢氧化为Fe3+,过氧化氢被还原成水。过氧化氢在酸性和中性介质中较稳定,在碱性介质中易分解。用波长为320~380nm的光照射会使过氧化氢分解速度加快,故过氧化氢应盛于棕色瓶中并放在阴凉处。在处理无水或浓缩过氧化氢时,必须在无尘、无金属杂质等条件下进行,以防止发生爆炸。
H2O2与Fe2+的混合溶液称为芬顿试剂(Fenton)。某些离子如Fe2+、Ti3+催化下,过氧化氢分解反应会生成自由基中间体HO·(羟基自由基)和HOO·。
一般使用的双氧水中都会含有一定量的稳定剂,以减少过氧化氢的分解。常用的稳定剂包括:锡酸钠、焦磷酸钠、8-羟基喹啉和有机亚磷酸酯。[4]
过氧化氢可在水溶液中氧化或还原很多无机离子。用作还原剂时产物为氧气;用作氧化剂时产物为水,其优点是氧化性强,还原产物为水,不引入杂质且不污染环境,因此过氧化氢是一种用途十分广泛的氧化剂。例如酸性溶液中,过氧化氢可将Fe2+氧化为Fe3+:

与过氧化氢作用,亚硫酸根(SO32−)可被氧化为硫酸根(SO42−),高锰酸钾在酸性溶液中会被还原为Mn2+。由于标准电极电势的缘故,反应在不同pH环境下进行的方向可能不同,如碱性溶液中,过氧化氢会将Mn2+氧化为MnIV,以MnO2形式生成。
过氧化氢还原次氯酸钠的反应可用于在实验室中制备氧气:

有机化学中,过氧化氢常用作氧化剂,可将硫醚氧化为亚砜。甲基苯基硫醚与其反应时,会被氧化为甲基苯基亚砜,以甲醇作溶剂或三氯化钛催化,产率为99%:

过氧化氢的碱性溶液可用于富电子烯烃(如丙烯酸)的环氧化反应,以及在硼氢化-氧化反应第二步中氧化烷基硼至醇。
过氧化氢与很多无机或有机化合物反应时,过氧链保留并转移到另一分子上,生成新的过氧化物:

与水相比,过氧化氢的碱性要弱得多,只有与很强的酸反应才会生成加合物。超强酸HF/SbF5可将过氧化氢质子化,生成含[H3O2]+离子的产物。
一般低浓度(如3%)的过氧化氢,主要用于杀菌及外用的医疗用途,例如作为伤口消毒。检验血液的最佳比率:6%的双氧水加上0.005%的亚甲蓝。至于较高浓度者(大于10%),则用于纺织品、皮革、纸张、木材制造工业,作为漂白及去味剂。过氧化氢也是染发剂的成分之一,还用作合成有机原料(邻苯二酚)的材料,医药、金属表面处理剂,聚合引发剂等。还可用作火箭推进剂。
很多颜料、涂料中含有铅白。使用铅白的油画、壁画等艺术品长时间暴露在空气中,与硫化氢作用生成硫化铅而变暗发黑,用过氧化氢涂刷后,会生成白色的硫酸铅从而使其复原。
| 此章节没有列出参考或来源。 (2012年11月12日) |
标签:
原文地址:http://www.cnblogs.com/biopy/p/4744361.html